| Актин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ленточная диаграмма G-актина. АДФ, связанный с активным сайтом актина (многоцветные полоски рядом с центром рисунка), а также комплексный дикатион кальция (зеленая сфера) выделены. | |||||||||
| Идентификаторы | |||||||||
| Символ | Актин | ||||||||
| Pfam | PF00022 | ||||||||
| InterPro | IPR004000 | ||||||||
| PROSITE | PDOC00340 | ||||||||
| SCOPe | 2btf / SUPFAM | ||||||||
| |||||||||
Актинпредставляет собой семейство из глобальных многофункциональных белков, которые образуют микрофиламенты. Он обнаружен практически во всех эукариотических клетках, где он может присутствовать в более 100 мкМ ; его масса составляет примерно 42- кДа при диаметре от 4 до 7 нм.
Белок актина - это мономерная субъединица двух типов филаментов в клетках: микрофиламентов, одного из трех основных компонентов цитоскелет и тонкие нити, являющиеся частью сократительного аппарата в мышечных клетках. Он может присутствовать либо в виде свободного мономера, называемого G-актин(глобулярный), либо в виде части линейного полимерного микрофиламента, называемого F-актин(нитчатый), оба из которых необходимы для таких важных клеточных функций, как подвижность и сокращение клеток во время деления клеток.
Актин участвует во многих важных клеточных функциях. процессы, сокращение мышц , клеточную подвижность, деление клеток и цитокинез, везикулы и движение органелл, передача сигналов клетки, а также установление и поддержание соединений клеток и формы клетки. Многие из этих опосредуются обширными и тесными взаимодействиями актина с мембранами. У позвоночных были идентифицированы три основные группы изоформ актина, альфа, бета и гамма. Альфа-актины, обнаруженные в мышечных тканях, являются основной составляющей сократительного аппарата. Бета- и гамма-актины сосуществуют в большинстве типов компонентов клеток цитоскелета и как медиаторы внутренней подвижности клетки . Считается, что разнообразный спектр структур, образованных актином, позволяющих ему выполнять такой диапазон функций, регулируется посредством связывания тропомиозина вдоль филаментов.
Способность клетки динамически формирует микрофиламенты обеспечивает каркас, который позволяет ему быстро переделывать себя в ответ на текущее или внутренние сигналы организма, например, для увеличения увеличения клеточной мембраной или увеличения клеточной адгезии для формирования клетки ткань. Другие ферменты или органеллы, такие как реснички, могут быть прикреплены к каркасу, чтобы контролировать деформацию внешней клеточной мембраны, что позволяет эндоцитозу и цитокинез. Он также может осуществлять движение самостоятельно или с помощью молекулярных двигателей. Следовательно, актин обеспечивает такой процессам, как внутриклеточный транспорт везикул и органелл, а также мышечное сокращение и клеточная миграция. Следовательно, он играет важную роль в эмбриогенезе, заживлении ран и инвазивности раковых клеток. Эволюционное происхождение актина можно проследить до прокариотических клеток, которые имеют эквивалентные белки. Гомологи актина прокариот и архей полимеризуются в различные спиральные или линейные филаменты, состоящие из одной или нескольких цепей. Однако внутрицепочечные контакты и сайты связывания нуклеотидов сохраняются у прокариот и архей. Наконец, актин играет роль в контроле экспрессии гена .
Большое количество болезней вызвано мутациями в аллелях генов, которые регулируют выработку актина или связанных с ним белков. Производство актина также является ключом к процессу заражения некоторыми патогенными микроорганизмами. Мутации в различных генах, регулирующие выработку актина у людей, могут вызывать мышечные заболевания, изменения размера и функции сердца, а также глухоту. Строение цитоскелета связано с патогенностью внутриклеточных бактерий и вирусов, особенно в процессах, связанных с уклонением от действий иммунной системы.
Актин был впервые обнаружен экспериментально в 1887 году WD. Halliburton, который извлек из мышц белок, который «коагулирует» препараты миозина, которые он назвал «миозин-ферментом». Однако компания Halliburton не смогла бы дополнительно уточнить свои открытия, и открытие актина приписывается Бруно Ференцу Штраубу, молодому биохимику, работающему в Альберту Сент-Дьерди <306 Лаборатория>в Институте химии Университета Сегеда, Венгрия.
После открытия Илоны Банга и Сент-Дьерди в 1941 г. коагуляция происходит только в некоторых экстрактах мизозина и отменяется при добавлении АТФ, Straub идентифицировал и очищал актин из тех препаратов миозина, которые действительно коагулировали. Основываясь на оригинальном методе экстракции Банги, он разработал новый метод извлечения мышечного белка, который позволил ему большие количества относительно чистого актина, опубликованном в 1942 году. Метод Штрауба по сути тот же, который используется сегодня в лабораториях. Был необходим для активации коагагуляции миозина, его назвали актином. Понимая, что препараты коагулирующего миозина Банги также содержат актин, Сент-Дьёрдьи назвал смесь обоих белков актомиозином.
Военные действия Второй мировой войны означало, что Сент-Дьёрдьи не смогли опубликовать результаты своей лаборатории. в Западных научных журналах. Таким образом, актин широко известен на Западе только в 1945 году, когда их статья была опубликована в качестве дополнения к Acta Physiologica Scandinavica. Штрауб продолжал работать над актином, и в 1950 году сообщил, что актин содержит связанный АТФ и что во время полимеризации белка в микрофиламенты, нуклеотид представляет собой гидролизованный до ADP и неорганический фосфат (которые остаются связанными с микрофиламентом). Штрауб предположил, что преобразование АТФ-связанного актина в АДФ-связанное актин играет роль в мышечном сокращении. Фактически, это верно только для гладкой мускулатуры и не подтверждалось экспериментами до 2001 года.
Аминокислотное секвенирование актина было завершено М. Эльзингой. и соавт. в 1973 году. Кристаллическая структура G-актина была решена в 1990 году Кабшем и его коллегами. В том же году Холмс и его коллеги предложили модель F-актина после экспериментов с использованием совместной кристаллизации с различными белками. Процедура совместной кристаллизации различных белков использовалась неоднократно в течение следующих лет, пока в 2001 году изолировался белок не кристаллизовался вместе с АДФ. Однако до сих пор нет рентгеновской структуры F-актина с высоким разрешением. Кристаллизация F-актина стала возможной благодаря использованию конъюгата родамин, который препятствует полимеризации, блокируя аминокислоту cys-374. Кристин Ориол-Аудит умерла в том же году, когда актин был впервые кристаллизован, но она был исследователем, который в 1977 году впервые кристаллизовал актин в отсутствие актин-связывающих белков (ABP). Однако полученные кристаллы были слишком малы для доступной технологии того времени.
Хотя в настоящее время не существует нитевидной формы актина с высоким разрешением, в 2008 году Савайи смогла создать более точную модель его структуры. на основе множества кристаллов актина димеров, связываются в разных местах. Впечатление эта модель была усовершенствована Савайей и Лоренцем. Другие подходы, такие как использование криоэлектронной микроскопии и синхротронного излучения, недавно позволили повысить разрешение и лучше понять при взаимодействий и конформационных изменений, связанных с образованием актиновых филаментов..
Аминокислотная последовательность актина является одной из наиболее консервативных белков, так как она мало изменилась в течение эволюция, отличаясь не более чем на 20% в богат, столь же разнообразных, как водоросли и люди. Поэтому, что он имеет оптимизированную форму . Он имеет две отличительные особенности: это фермент , который медленно гидролизует АТФ, «универсальную энергетическую валюту» биологических процессов. Однако для сохранения структурной целостности требуется АТФ. Его эффективная структура сформирована почти уникальное процесс складывания. Кроме того, он способен выполнять больше взаимодействий, чем любой другой белок, что позволяет ему выполнять более широкий спектр функций, чем другие белки на всех уровнях клеточной жизни. Миозин является примером белка, который связывается с актином. Другой пример - виллин, который может сплетать актин в пучки или разрезать волокна в зависимости от концентрации катионов кальция в окружающей среде.
Актин является одним из наиболее распространенных белки у эукариот, где он обнаружен по всей цитоплазме. Фактически, в мышечных волокнах он составляет 20% от общего клеточного белка по весу и от 1% до 5% в других клетках. Однако существует не только один тип актина; гены, которые кодируют актин, устойчивое как семейство генов (семейство, которое в растениях содержит более 60 элементов, включая гены и псевдогены, а у людей более чем 30 элементов). Это означает, что генетическая информация каждого человека содержит инструкции, которые генерируют варианты актина (называемые изоформами ), которые обладают разными функциями. Это, в свою очередь, означает, что эукариотические организмы экспрессируют различные гены, дающие начало: α-актину, который обнаружен в сократительных структурах; β-актин, используемый в расширяющейся границе клеток, который использует своих клеточных структур как средство передвижения; и γ-актин, который находится в филаментах стресс-волокон. В дополнение к сходству, которое существует между изоформами организма, существует также эволюционная консервация в структуре и функциях даже между организмом, существимися в разных эукариотических доменах. У бактерий был идентифицирован актин гомолог MreB, который представляет собой белок, способный полимеризоваться в микрофиламенты; а у архей гомолог Ta0583 даже больше похож на эукариотические актины.
Клеточный актин имеет две: мономерные глобулы, называемые G-актином, и полимерные формы филаменты, называемые F-актином (то есть филаменты, состоящие из многих мономеров G) -актина). F-актин также можно описать как микрофиламент. Две параллельные нити F-актина должны повернуться на 166 градусов, чтобы правильно ложиться друг на друга. Это двойная спиральная структура микрофиламентов цитоскелета. Микроволокна имеют диаметр приблизительно 7 нм, причем спираль повторяется каждые 37 нм. Каждая молекула актина связана с молекулой аденозинтрифосфата (АТФ) или аденозиндифосфата (ADP), которая связана с катионом Mg. Наиболее часто встречающимися формами актина по со всеми возможными комбинациями являются АТФ-G-актин и АДФ-F-актин.
Изображение, полученное с помощью сканирующего электронного микроскопа, показывает, что G -актин имеет глобулярную структуру; однако рентгеновская кристаллография показывает, что каждая из этих глобул состоит из двух долей, разделенных щелью. Эта структура представляет собой «складку АТФазы», которая является основой ферментативного катализа, который связывает АТФ и Mg и гидролизует первый до АДФ плюс фосфат. Эта складка является консервативным структурным мотивом, которая также присутствует в других белках, которые взаимодействуют с трифосфатными нуклеотидами, такими как гексокиназа (фермент, используемый в энергетическом метаболизме ) или в Белки Hsp70 (семейство белков, играющих роль в укладке белков). G-актин функционирует только тогда, когда он содержит АДФ или АТФ в своей щели, но форма, связанная с АТФ, преобладает в клетках, когда актин присутствует в свободном состоянии.
Ленточная модель актина, экстрагированного из поперечнополосатая мышечная ткань кролика по Graceffa and Domínguez, 2003. Можно увидеть четыре субдомена , а также N и C -концы и положение связи АТФ. Молекула ориентируется с использованием обычного соглашения о размещении минус-конца (заостренный конец) в верхней части и плюсового конца (зазубренный) в нижней части.Рентгеновский снимок кристаллографическая модель актина, полученная Кабшем из поперечнополосатой мышечной кроликов , наиболее часто используемой в структурных исследованиях, поскольку она была первой очищенной . G-актин, кристаллизованный Кабшем, имеет размер приблизительно 67 x 40 x 37 Å, имеет молекулярную массу 41,785 Da и примерно изоэлектрический пункт из 4.8. Его чистый заряд при pH = 7 равен -7.
Эльзинга и его сотрудники сначала определили полную пептидную последовательность для этого типа актина в 1973 году, а более поздние работы того же автора добавили дополнительные детали к модели. Он содержит 374 аминокислот остатков. Его N-конец является очень кислым и начинается с ацетилированного аспартата в своей аминогруппе. В то время как его С-конец является щелочным и образован фенилаланином, соответствующий предшествует цистеин, который имеет определенную степень функционального значения. Обе крайности находятся в непосредственной близости внутри I-подобласти. Аномальный N-метилгистидин находится в позиции 73.
Третичная структура образована двумя доменами, известными как большие и малые, которые разделены щелью с центром вокруг места связи с АТФ - АДФ +Pi. Ниже находится более глубокая выемка, называемая «канавкой». В нативном состоянии, несмотря на их названия, оба имеют сопоставимую глубину.
Обычное соглашение в топологических исследованиих означает, что белок показан самым большим доменом на левой правой части и самой маленькой области в части. В этом положении меньший домен, в свою очередь, делится на два: субдомен I (нижнее положение, остатки 1–32, 70–144 и 338–374) и субдомен II (верхнее положение, остатки 33–69). Более крупный домен также делится на два: субдомен III (нижний, остатки 145–180 и 270–337) и субдомен IV (верхний, остатки 181–269). Открытые области доменов I и III называются «зазубренными» концами, а открытые области доменов II и IV называются «заостренными» концами. Эта номенклатура относится к тому факту, что из-за небольшого субдомена Актин II полярен; важность этого будет обсуждаться ниже при обсуждении динамики сборки. Некоторые авторы называют субдомены Ia, Ib, IIa и IIb соответственно.
Наиболее заметная супервторичная структура представляет собой пятицепочечный бета-лист, который состоит из β-меандра и β-α-β элемента по часовой стрелке. Он присутствует в обоих доменах, что позволяет предположить, что белок возник в результате дупликации гена.
Классическое описание F-актина утверждает, что он имеет нитевидную структуру, которую можно рассматривать как одноцепочечную левовращающую спираль с поворотом на 166 ° вокруг спиральной оси и осевым перемещением 27,5 Å, или одноцепочечная правовращающая спираль с шагом перекрестка 350–380 Е, причем каждый актин окружен еще четырьмя. Симметрия полимера актина на уровне 2,17 субъединиц на обороте спирали несовместима с образованием , что возможно только при симметрии точно в 2, 3, или 6 субъединиц на оборот. Следовательно, необходимо построить модели, объясняющие эти аномалии, используя данные электронной микроскопии, криоэлектронной микроскопии, кристаллизации димеров в различных положениях и дифракция рентгеновских лучей. Следует отметить, что неправильно говорить о «структуре» молекулы, столь же динамичной, как актиновый филамент. На самом деле мы говорим о различных функциях состояния, в которых измеряется постоянным изменением уровня 27,5 A, в то время как данные о вращении субъединицы демонстрируют значительнуючивость с обычно наблюдаемыми смещениями до 10% от ее оптимального положения. Некоторые белки, такие как кофилин, по-видимому, увеличивают угол поворота, но снова это можно интерпретировать как установление различных структурных состояний. Они могут быть важны в процессе полимеризации.
Существует меньшее относительно измерений радиуса витка и толщины нити: в то время как первые модели приписывали длину 25 Å, текущие данные дифракции рентгеновских лучей, подкрепленные криоэлектронная микроскопия предполагает длину 23,7 Å. Эти исследования показали точные точки контакта между мономерами. Некоторые из них образованы звеньями одной и той же цепи между «зазубренным» концом одного мономера и «заостренным» концом следующего. В то время как мономеры в соседних цепях образуют боковой контакт через выступы субдомена IV, причем наиболее важными выступами являются выступы, образованные С-концом и образованной связью, образованной тремя телами, включающими остатки 39–42, 201–203 и 286. Это Модель предполагает , что филамент образован мономерами в виде "листового" образования, в котором субдомены вращаются вокруг себя, эта также обнаружена в бактериальном гомологе актина MreB.
Полимер F-актина считается имеющим структурная полярность из-за того, что все субъединицы микрофиламентация на один конец. Это приводит к соглашению об именах: конец, который содержит субъединицу актина, у которой сайт связывания АТФ, называется «(-) концом», тогда как противоположный конец, где щель направлена на другой соседний мономер, называется «(+) конец ". Термины« заостренный »и« зазубренный », относящиеся к двум концам микрофиламентов, просвечивающая электронную микроскопию , когда образцы исследуются с использованием методики подготовки, называемой« декорирование ». добавление фрагментов миозина S1 к ткани, которая зафиксирована с помощью дубильной кислоты. Этот миозин образует полярные связи с мономерами актина, создавая конфигурацию, которая выглядит как стрелы с оперением пера вдоль его стержня, Следуя этой логике, конец микрофиламента, на котором нет выступающего миозина, называется острием стрелки (- конец), другой конец - зазубренным концо. м (+ конец). Фрагмент S1 состоит из доменов головы и шеи миозина II. В физиологических условиях G-актин (форма мономера ) преобразуется в F-актин (полимера ) под действием АТФ, где роль АТФ важна.
Спиральная нить F-актина, обнаруженная в мышцах, также содержит молекулу тропомиозина, которая представляет собой белок длиной 40 нанометров, который обернут вокруг спирали F-актина. Во время фазы покоя тропомиозин покрывает активные участки актина, так что взаимодействие актин-миозин не может иметь место и сокращать мышцы. Есть другие белковые молекулы, связанные с тропомиозиновой нитью, это тропонины, которые имеют три полимера: тропонин I, тропонин T и тропонин C..
Актин может спонтанно приобретать большую часть своей третичной структуры. Способ его полностью функциональной формы из его недавно синтезированной нативной формы является особым и почти уникальным в химии белков. Причиной этого особого пути может быть необходимость избежать присутствия неправильных свернутых меров актина, которые могут действовать как неэффективные терминаторы полимеризации. Это не менее важный процесс для установки цитоскелета, и, кроме того, это важный процесс для первичного клеточного цикла ..
CCT необходим для того, чтобы гибкое правильное сворачивание. CCT - это шаперонин группы II, большой белковый комплекс, который помогает в сворачивании других белков. CCT состоит из двойного кольца из восьми различных субъединиц (гетерооктамерных), и он отличается от шаперонинов группы I, таких как GroEL, который содержится в Eubacteria и эукариотических органеллах, поскольку он не требует совместной работы. шаперон, действующая крышка над центральной каталитической полостью . Субстраты связываются с CCT через задний домены. Первоначально считалось, что он связывается только с актином и тубулином, хотя недавние исследования иммунопреципитации показали, что он взаимодействует с большим количеством полипептидов, которые, возможно, функционируют как подложки. Он действует через АТФ-зависимые конформационные изменения, которые иногда требуют нескольких раундов высвобождения и катализа для реакций.
Для успешного завершения сворачивания и актин, и тубулин могут взаимодействовать с другим белком, называемым префолдин, который представляет собой гетерогексамерный комплекс (образованный шестью индивидуально индивидуально), во взаимодействии, которое настолько специфично, что молекулы совместно развились. Комплексы актина с префолдином, пока он все еще формируется, когда он составляет 145 аминокислоты в длину, особенно те, которые находятся на N-конце.
Для актина или актина используются различные субъединицы распознавания. тубулин, хотя есть некоторое перекрытие. В актине субъединицы, которые связываются с префолдином, вероятно, представляют собой PFD3 и PFD4, которые связываются в двух местах: одно между остатками 60–79 и между остатками 170–198. Актин распознается, загружается и доставляется к цитозольному шаперонину (CCT) в открытой конформации внутренним концом «щупалец» префолдина (см. Изображение и примечание). Контакт при доставке актина настолько краток, что возникает третичный комплекс не образуется, немедленно освобождает префолдин.
Ленточная модель апикального γ-домена шаперонина CCTCCT затем вызывает последовательное сворачивание актина, образуя связи с его субъединицами, а не просто заключенная в его полости. Вот почему он обладает специфическими участками узнавания в своем апикальном β-домене. Первая стадия сворачивания из распознавания остатков 245–249. Затем другие детерминанты устанавливают контакт. И актин, и тубулин связываются с CCT в открытых конформациях в отсутствие АТФ. В случае актина две субъединицы связываются во время каждого конформационного изменения, тогда как связывание тубулина происходит с четырьмя субъединицами. Актин имеет специфические связывающие реакции, которые взаимодействуют с субъединицами δ и β-CCT. r с δ-CCT и ε-CCT. После связывания AMP-PNP с CCT субстраты перемещаются в полости шаперонина. Также кажется, что в случае актина белок САР необходим в качестве возможного кофактора в качестве конечных состоянийх фолдинга актина.
Точный способ, которым регулируется этот процесс, все еще не полностью понятно, но известно, что белок PhLP3 (белок, подобный фосдуцину ) подавляет его активность за счет образования третичного комплекса.
Актин представляет собой АТФазу, что означает, что это фермент, который гидролизует АТФ. Эта группа ферментов отличается медленной скоростью реакции. Известно, что эта АТФаза «активна», то есть ее скорость увеличивается примерно в 40 000 раз, когда актин образует часть филамента. Контрольное значение этой скорости гидролиза в идеальных условиях составляет около 0,3 с. Затем P i остается неизменным с актином с ADP в долгого времени, пока он совместно не высвобождается рядом из внутренней части филамента.
Точные молекулярные детали каталитического действия. механизм до сих пор до конца не изучен. Хотя по этому поводу ведется много споров, очевидно, что для гидролиза АТФ требуется «закрытая» конформация, и считается, что остатки участвуют в процессе, перемещаются на соответствующее расстояние. глутаминовая кислота Glu137 является одним из ключевых остатков, который расположен в субдомене 1. Его функция заключается в связывании молекулы воды, которая вызывает нуклеофильную атаку на γ-фосфат АТФ связь, в то время как нуклеотид прочидно связан с субдоменами 3 и 4. Медленность каталитического процесса обусловлена большим расстоянием и перекосом положения молекулы воды по отношению к реагенту. Весьма вероятно, что конформационные изменения, вызываемые вращением доменов между формой G и F актина, перемещают Glu137 ближе, его гидролиз. Эта модель предполагает, что полимеризация и функция АТФазы будут разделены сразу. Преобразование "открытое" в "закрытое" между формами G и F и его влияние на относительное движение нескольких ключевых остатков и образования водяных нитей было охарактеризовано в молекулярной динамике и QM / MM. моделирования.
Актин был одним из наиболее консервативных белков на протяжении всей эволюции. Он имеет 80,2% дрожания консервативности на уровне гена между Homo sapiens и Saccharomyces cerevisiae (разновидностьжей), и 95% сохранение первичной структуры белкового продукта.
Как правило, экспрессируют несколько изоформ актина, имеют только один ген актина, имеют только один ген актина, высшие эукариоты. кодируемых семейством родственных генов. Млекопитающие имеют по крайней мере шесть изоформ актина, кодируемых отдельными генами, которые разделены на три класса (альфа, бета и гамма) в соответствии с их изоэлектрическими точками. В целом, альфа-актины обнаруживаются в мышцах (α-скелет, α-гладкая аорта, α-сердечная), тогда как бета- и гамма-изоформы заметны в немышечных клетках (β-цитоплазматические, γ1-цитоплазматические, γ2-кишечные гладкие). Хотя аминокислотные последовательности и in vitro свойства изоформ очень похожи, эти изоформы не могут полностью заменять друг друга in vivo.
Типичный ген актина имеет примерно 100-нуклеотидный 5 'UTR, 1200-нуклеотидная транслируемая область и 200-нуклеотидная 3' UTR. Большинство генов актина прервано интронами, причем до шести интронов в любом из 19 хорошо охарактеризованных мест. Высокая сохранность семейства делает актин предпочтительной моделью для исследований, сравнивающих интронно-раннюю и интрон-позднюю модели эволюции интрона.
Все несферические прокариоты, по-видимому, обладают такими генами, как MreB, которые кодируют гомологи актина; эти гены необходимы для сохранения формы клетки. Ген ParM, производный от плазмиды, кодирует актин-подобный белок, полимеризованная форма которого динамически нестабильна, и, по-видимому, разделяет плазмидную ДНК на дочерние клетки во время клетки деление по механизму, аналогичному тому, который используется микротрубочками в митозе эукариот. Актин содержится как в гладкой, так и в шероховатой эндоплазматической сети.
Для стимуляции полимеризации актина необходимы нуклеирующие факторы. Одним из таких факторов зародышеобразования является комплекс Arp2 / 3, который имитирует димер G-актина, чтобы стимулировать зародышеобразование (или образование первого тримера) мономерного G-актина. Комплекс Arp2 / 3 связывается с актиновыми филаментами под углом 70 градусов с образованием новых ответвлений актина от существующих актиновых филаментов. Arp2 / 3-опосредованная нуклеация необходима для направленной миграции клеток. Кроме того, актиновые филаменты сами связывают АТФ, и гидролиз этого АТФ стимулирует дестабилизацию полимера.
Рост актиновых филаментов может регулироваться тимозином и профилином. Тимозин связывается с G-актином для буферизации процесса полимеризации, в то время как профилин связывается с G-актином для обмена АДФ на АТФ, способствуя присоединению мономера к зазубрине, плюс конец F- актиновые филаменты.
F-актин и сильный,, и динамичный. В отличие от других полимеров, таких как ДНК, составные элементы которых связаны вместе ковалентными связями, мономеры актиновых филаментов собираются более слабыми связями. Боковые связи с соседними мономерами разрешают эту аномалию, которая теоретически должна ослабить структуру, поскольку они могут быть разрушены тепловым перемешиванием. Кроме того, слабые связи дают то преимущество, что концы волокон могут легко высвобождать или включать мономеры. Это означает, что волокна могут быстро перестраиваться и изменять клеточную структуру в ответ на раздражитель окружающей среды. Которая, наряду с биохимическим механизмом, с помощью которого это происходит, известна как «динамика сборки».
Проводятся исследования, посвященные накоплению и потере субъединиц микрофиламентами in vitro (то есть в лаборатории, а не в клеточных системах), поскольку полимеризация образующегося актина дает тот же F-актин, что и продуцируемый in vivo. Процесс in vivo контролируется наборами белков, чтобы заставить его реагировать на потребности клеток.
Производство in vitro происходит последовательно: во-первых, там это «фаза активации», связывание и двухвалентный обмен в определенных местах на G-актине, который связан с АТФ. Это конформационное изменение, иногда называемое G * -актином или F-действие в мономере, так как он очень похож на элементы, расположенные на нити. Это подготавливает его к «фазе зародышеобразования», в котором G-актин дает начало небольшому нестабильным фрагментам F-актина, которые способны полимеризоваться. Первоначально образуются нестабильные димеры и тримеры. «Фаза удлинения» начинается, когда имеется достаточно большое количество этих коротких полимеров. На этом этапе филамент формируется и быстро растет за счет обратного добавления новых мономеров в обоих крайних случаях. Наконец, стационарное равновесие достигается, когда мономеры G-актина обмениваются на обоих концах микрофиламента без какого-либо изменения его общей длины. На этой последней фазе «критическая оценка C c » определяется как отношение между константой сборки и константой диссоциации для G-актина, где динамика для добавления и удаления димеры и тримеры не вызывают изменения длины микрофиламента. В условиях in vitro C c составляет 0,1 мкМ, что означает, что при более высоких значениях происходит полимеризация, а при более низких значениях - деполимеризация.
Как указано выше, хотя актин гидролизует АТФ, все указывает на тот факт, что АТФ не требуется для сборки актина, учитывая, что, с одной стороны, гидролиз в основном происходит внутри филамента, а с другой стороны, АДФ может также спровоцировать полимеризацию. Это ставит вопрос о понимании того, какой термодинамически неблагоприятный процесс требует таких колоссальных затрат энергии. Цикл актина, который связывает гидролиз АТФ с полимеризацией актина, включает предпочтительного добавления мономеров G-актин-АТФ к зазубренному концу филамента и одновременной разборки мономеров F-актин-АДФ на заостренном конце, где присутствует АДФ. превратился в АТФ, тем самым замкнув цикл. Этот аспект образования актиновых филаментов известен как «беговая дорожка».
АТФ относительно быстро гидролизуется сразу после добавления мономера G-актина к филаменту. Есть две гипотезы относительно того, как это происходит; стохастический предполагает, что гидролиз происходит случайным образом, каким-то образом взаимодействует соседние молекулы; что гидролиз происходит рядом с молекулами, АТФ уже гидролизован. В любом случае результирующий P i не освобождается; он остается в течение некоторого времени нековалентно настоящее с АДФ актина. Таким образом, в филаменте существует три вида актина: АТФ-актин, АДФ + Р i -актин и АДФ-актин. Количество каждого из этих видов, зависит от его присутствия и состояний: когда начинается удлинение, начинается равное количество мономеров, связанное с АТФ и АДФ + P i , и небольшое количество АДФ-актина на (-) конце. По достижении стационарного состояния ситуация меняется на противоположную: АДФ присутствует вдоль большей части филамента и только в области, ближайшей к (+) концу, содержащей АДФ + Р i , а АТФ присутствует только на конце.
Если мы сравним филаменты, которые содержат только АДФ-актин, с филаментами, содержащиеими АТФ, в первом случае критических константы схожи на обоих концах, в то время C c для двух других нуклеотидов отличается : На (+) конце Cc = 0,1М, а на (-) конце Cc = 0,8 мкМ, что приводит к следующей ситуации:
Таким образом, можно сделать вывод, что одна энергия, производимая гидролизом, используется для создания истинного «стационарного состояния», это динамический, полярный и прикрепленный к нити накала. Это оправдывает затраты энергии, так как полезные функции. Кроме различных типов мономеров, устанавливаются соответствующие актин белками, которые также контролируют этот динамизм.
Было обнаружено, что формирование микрофиламентов при беговой дорожке нетипично в стереоцилиях. В этом контроле структуры структуры полностью контролируется экспрессией генов, то есть есть общим белковым мономера, синтезируемого в любой данный момент.
Актиновый цитоскелет in vivo не только из актина, необходимы другие белки. за его формирование, продолжение и функцию. Эти белки называются актин-связывающими белками (ABP), и они участвуют в полимеризации актина, деполимеризации, стабильности, организации в пучки или сети, фрагментации и разрушении. Разнообразие этих белков таково, что актин считает белком, который принимает наибольшее количество белок-белковых взаимодействий. Например, существуют элементы, изолирующие G-актин, которые препятствуют его включению в микрофотографии. Существуют также белки, которые стимулируют его полимеризацию или придают сложность синтезирующим сетям.
Другие белки, которые связываются с актином, регулируют микрофиламентов путем разрезания их, что дает начало новым активным концам полимеризации. Например, если микрофиламент с двумя концами разрезать дважды, получится три новых микрофиламента с шестью концами. Эта новая ситуация способствует динамике сборки и разборки. Наиболее заметными из этих белков являются гельсолин и кофилин. Эти белки сначала достигают разреза за счет связывания с мономером актина, затем изменяют конформацию мономера актина, оставаясь связанными с вновь образованным (+) концом. Это препятствует добавлению или обмену новых субъединиц G-актина. Деполимеризация наполняется, поскольку (-) концы не связаны с какой-либо другой молекулой.
Другие белки, которые связываются с актином, покрывают концы F-актина, чтобы их стабилизировать, но они не могут их разрушить. Примерами этого типа являются CapZ, который связывает (+) концы в зависимости от уровня Ca /кальмодулина в клетке. Эти уровни от внутренних и внешних сигналов клетки участвуют в регуляции ее биологических функций). Другой пример - тропомодулин (который связывается с (-) концом). Тропомодулин в основном действует для стабилизации F-актина, присутствующего в миофибриллах, присутствующих в мышце саркомерах, которые обеспечивают структуру, характеризующиеся большой стабильностью.
Атомная структура Арп2 / 3. Каждому цвету соответствует субъединица: Arp3, оранжевый; Arp2, цвет морской волны (субъединицы 1 и 2 не показаны); п40, зеленый; p34, голубой; p20, темно-синий; p21, пурпурный; р16, желтый.Комплекс Arp2 / 3 широко широко широко распространен во всех эукариотических организмах. Он состоит из семи из семи субъединиц, которые обладают аналогичной структурой , которая явно связана с их биологической функцией: две из них, ARP2 и ARP3, имеют соответствующую структуру мономеров актина. Эта гомология позволяет обеим единицам действовать как агенты зародышеобразования при полимеризации G-актина и F-актина. Этот комплекс также необходим в более сложных процессах, таких как создание дендритных структур, а также в анастомозе (повторное соединение двух ветвящихся структур, которые были ранее соединены, например, в кровеносных сосудах).
Существует ряд токсинов, которые действуют на динамику актина, предотвращая его полимеризацию (латрункулин и цитохалазин D ) или путем его стабилизации (фаллоидин ):
Актин образует филаменты ('F-актин' или микрофиламенты ) важными элементами эукариотического цитоскелета, которые претерпевать очень быструю динамику полимеризации и деполимеризации. В большинстве клеток актиновые филаменты образуют более крупномасштабные сети, необходимые для основных функций в клетках:
Белок актина находится как в цитоплазме, так и в ядро клетки. Его расположение регулируется путями сигнала передачи клеточной мембраны, которые интегрируют стимулы, которые получают клетка, стимулируют реструктуризацию актиновых сетей в ответ. В Dictyostelium было обнаружено, что фосфолипаза D вмешивается в пути инозитолфосфата. Нити актина особенно стабильны и многочисленны в мышечных волокнах. В саркомере (основная морфологическая и физиологическая единица мышечных волокон) актин присутствует как в I, так и в A-полосах; миозин также присутствует в последнем.
Микрофиламенты участвуют в движении всех подвижных клеток, включая немышечные типы, и препараты, которые нарушают организацию F-актина (такие как цитохалазины ), действуют на активность этих клеток. Актин составляет 2% от общего количества белков в гепатоцитах, 10% в фибробластах, 15% в амебах и до 50–80% в активированных тромбоцитах. Есть несколько различных типов актина с разными структурами и функциями. Это означает, что α-актин находится исключительно в мышечных волокнах, тогда как типы β и γ обнаруживаются в других клетках. Кроме того, как используются последние данные, высокопроизводительные функции. Это означает, что микрофиламенты, обнаруженные в клетках, отличных от мышечных, представленных в трех формах:
Цитоскелет актина является ключом к процессам эндоцитоза, цитокинеза, определение клеточной полярности и морфогенеза в дрожжах. Помимо опоры на актин, в эти процессы вовлечены 20 или 30 ассоциированных белков. Вместе эти элементы пространственно и временно модулированную сборку, которая вызывает реакцию как на внутренние, так и на внешние стимулы.
Дрожжи содержат три основных элемента, связанных с актином: пятна, кабели и кольца, которые, несмотря на то, что они не используются в течение длительного времени, подвержены динамическому равновесию из-за непрерывной полимеризации и деполимеризации. Они обладают рядом белков, включая ADF / кофилин, который кодируется одним геном, называемым COF1; Aip1, кофактор кофилина, который обеспечивает разборке микрофиламентов; Srv2 / CAP, регулятор процесса, связанный с белками аденилатциклазы ; профилин с молекулярной массой приблизительно 14 кДа, родственный / связанный с мономерами актина; и твинфилин, белок 40 кДа, участвующий в организации пятен.
Растения Геном выявили существование изовариантов белка в семействе генов актина. В Arabidopsis thaliana, двудольном, используемом в модельном организме, используется десять типов актина, девять типов α-тубулинов, шесть β-тубулинов, шесть профилины и десятки миозинов. Это разнообразие объясняется эволюционной необходимой способностью, немного различающейся по своему временному и пространственному выражению. Большинство этих белков совместно экспрессировалось в проанализированной ткани. Актиновые сети распределены по клеткам цитоплазме, которые были культивированы in vitro. Вокруг ядра имеется сети, которая соединена спицами с клеточной корой, эта сеть очень динамична, с непрерывной полимеризацией и деполимеризацией.
Структура С-концевого субдомена виллин, белок, способный расщеплять микрофиламенты. Несмотря на то, что большинство растительных клеток имеют их клеточную стенку, которая определяет достаточную силу для достижения определенных клеточных активностей, таких как цитоплазматические токи, генерируемые микрофиламентами и миозином, они могут генерировать достаточную силу для достижения определенных клеточных активностей. Актин также участвует в движении органелл и клеточном морфогенезе, который включает деление клеток, а также удлинение и дифференцировку клетки.
Наиболее известные белки, связанные с актиновым цитоскелетом. в растениях включают: виллин, который принадлежит к тому же семейству, что и гельсолин / северин, и способен разрезать микрофиламенты и связывать мономеры актина в присутствии катионов кальция; фимбрин, который способен распознавать и объединять мономеры актина и который участвует в образовании сетей (посредством процесса регуляции, отличного от такового у животных и дрожжей); формины, которые являются способен действовать как зародышеобразователь полимеризации F-актина; миозин, типичный молекулярный мотор, который специфичен для эукариот и который у Arabidopsis thaliana кодируется 17 генами двух различных классов; CHUP1, который может связывать актин и участвует в пространственном распределении хлоропластов в клетке; KAM1 / MUR3, которые определяют морфологию аппарата Гольджи, а также состав ксилоглюканов в клеточной стенке; NtWLIM1, который способствует появлению актиновых клеточных структур; и ERD10, который участвует в ассоциации органелл внутри мембран и микрофиламентов и, по-видимому, играет роль, которая участвует в реакции организма на стресс.
Ядерный актин был впервые замечен и описан в 1977 году Кларком и Мерриамом. Авторы описывают белок, присутствующий в ядерной фракции, полученной из ооцитов Xenopus laevis, который демонстрирует те же характеристики, что и актин скелетных мышц. С того времени появилось множество научных отчетов о структуре и функциях актина в ядре (см. Обзор: Hofmann 2009). Контролируемый уровень актина в ядре, его взаимодействие с актин-связывающими белками (ABP) и присутствие различных изоформ позволяет актину играть важную роль во многих важных ядерных процессах.
Последовательность актина не содержит сигнала ядерной локализации. Небольшой размер актина (около 43 кДа) позволяет ему проникать в ядро путем пассивной диффузии. Однако актин довольно быстро перемещается между цитоплазмой и ядром, что указывает на наличие активного транспорта. Импорту актина в ядро (вероятно, в комплексе с кофилином) способствует импортируемый белок импортин 9.
Низкий уровень актина в ядре кажется очень важным, потому что у актина есть два сигнала экспорта из ядра. (NES) в его последовательность. Микроинъектированный актин быстро выводится из ядра в цитоплазму. Актин экспортируется по крайней мере двумя способами: через exportin 1 (EXP1) и exportin 6 (Exp6).
Конкретные модификации, такие как SUMOylation, допускают ядерное задержка актина. Было продемонстрировано, что мутация, предотвращающая SUMOylation, вызывает быстрый экспорт бета-актина из ядра.
На основании экспериментальных результатов можно предположить общий механизм ядерного транспорта актина:
Ядерный актин существует в основном в виде мономера, но может также образовывать динамические олигомеры и короткие полимеры. Организация ядерного актина варьируется в разных типах клеток. Например, в ооцитах Xenopus (с более высоким уровнем ядерного актина по сравнению с соматическими клетками) актин образует филаменты, которые стабилизируют архитектуру ядра. Эти филаменты можно наблюдать под микроскопом благодаря окрашиванию фаллоидином, конъюгированным с флуорофором.
Однако в ядрах соматических клеток актиновые филаменты нельзя наблюдать с помощью этого метода. Анализ ингибирования ДНКазы I, пока единственный тест, который позволяет количественно определять полимеризованный актин непосредственно в биологических образцах, показал, что эндогенный ядерный актин действительно находится в основном в мономерной форме.
Точно контролируемый уровень актина в ядро клетки, расположенное ниже, чем в цитоплазме, препятствует образованию филаментов. Полимеризация также снижается из-за ограниченного доступа к мономерам актина, которые связаны в комплексы с ABP, в основном с кофилином.
Изоформам актина уделяется мало внимания; однако было показано, что в ядре клетки присутствуют разные изоформы актина. Изоформы актина, несмотря на большое сходство последовательностей, обладают разными биохимическими свойствами, такими как кинетика полимеризации и деполимеризации. Также они показывают различную локализацию и функции.
Уровень изоформ актина как в цитоплазме, так и в ядре может изменяться, например, в ответ на стимуляцию роста клеток или остановку пролиферации и транскрипционной активности.
Проблемы исследования ядерного актина обычно сосредоточены на бета-изоформе. Однако использование антител, направленных против различных изоформ актина, позволяет идентифицировать не только цитоплазматический бета в ядре клетки, но также:
Присутствие различных изоформ актина может иметь значительное влияние на его функцию в ядерных процессах, особенно потому, что уровень отдельных изоформ можно контролировать независимо.
Функции актина в ядре связаны с его способностью к полимеризации и взаимодействию с различными ABP и структурными элементами ядра. Ядерный актин участвует в:
Благодаря своей способности претерпевать конформационные изменения и взаимодействовать со многими белками, актин действует как регулятор образования и активности белковых комплексов, таких как транскрипционный комплекс.
В мышечных клетках актомиозин миофибриллы образуют вверх большую часть цитоплазматического материала. Эти миофибриллы состоят из тонких нитей актина (обычно диаметром около 7 нм) и толстых нитей моторного белка миозина (обычно диаметром около 15 нм). Эти миофибриллы используют энергию, полученную из АТФ, для создания движущихся клеток, таких как сокращения мышц. Используя гидролиз АТФ для использования энергии, миозиновые головки проходят цикл, в течение которого они прикрепляются к тонким волокнам, напряжение, а затем в зависимости от нагрузки, заставляет тонкие волокна волокна двигаться мимо, укорачивая.
В сократительных пучках связывающий актин белок альфа- актинин разделяет каждую тонкую нить на ≈35 нм. Это использование позволяет толстым нитям вставлять между ними и использовать, используя деформацию или напряжение. При деформации один конец миозина связан с плазматической мембраной, а другой конец «идет» к плюсовому концу актиновой нити. Это придает мембране форму, отличную от формы коры клетки. Для сокращения обычно связаны с двумя отдельными филаментами, и оба конца одновременно «идут» к положительному концу своей филамента, сдвигая филаменты актина ближе к другу. Это приводит к укорачиванию или сокращению актинового пучка (но не филамента). Этот механизм отвечает за сокращение мышц и цитокинез, деление одной клетки на две.
Спиральная нить F-актина, обнаруженная в мышцах, также содержит молекулу тропомиозина, белок размером 40- нанометров, который оборачивается вокруг спирали F-актина. Во время фазы покоя тропомиозин вызывает действие активных участков актина, так что взаимодействие актин-миозин вызывает сокращение (взаимодействие вызывает движение между двумя белками, которое, поскольку оно повторяется много раз, вызывает сокращение). Есть и другие белковые молекулы, связанные с тропомиозиновой нитью, к ним тропонины, которые имеют три полимера: тропонин I, тропонин T и тропонин C.. Регуляторная тропомиозина зависит от его взаимодействия с тропонином в использовании функция специ Са.
И актин, и миозин участвуют в сокращении и расслаблении мышц и составляют 90% мышечного белка. Общий процесс запуска внешнего сигналом, обычно через потенциал действия, стимулирующий мышцу, который содержит специализированные клетки, внутреннюю часть богата актиновыми и миозиновыми филаментами. Цикл сокращения-релаксации включает следующие этапы:
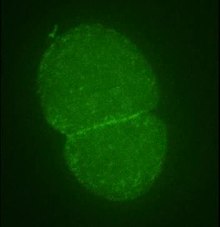 Play media Флуоресцентная визуализация динамики первого деления эмбриональных клеток C. elegans. Во-первых, актиновые филаменты собираются в верхней части клетки, тем самым внесли вклад в асимметричное деление клетки. Затем через 10 с можно создать формирование сократительного актинового кольца.
Play media Флуоресцентная визуализация динамики первого деления эмбриональных клеток C. elegans. Во-первых, актиновые филаменты собираются в верхней части клетки, тем самым внесли вклад в асимметричное деление клетки. Затем через 10 с можно создать формирование сократительного актинового кольца. Традиционное представление о функциях актина связывает ее с поддержкой цитоскелета и, следовательно, с организацией и движением органелл, а также с определением формы клетки. Однако актин играет более широкую роль в физиологии эукариотических клеток в дополнение к аналогичным функциям в прокариотах.
Большинство млекопитающих обладают шестью различными генами актина . Из них два кода для цитоскелета (ACTB и ACTG1 ), в то время как другие четыре участвуют в скелетно-поперечно-полосатой мышце (ACTA1 ), гладкой мышечной ткани (ACTA2 ), кишечных мышц (ACTG2 ) и сердечной мышцы (ACTC1 ). Актин в цитоскелете участвует в патогенных механизмах многих инфекционных агентов, включая ВИЧ. Подавляющие большинство мутаций , влияющие на актин, являются точечными мутациями, которые обладают доминантным эффектом, за заместителем шести мутаций, связанных с миопатией немалина. Это связано с тем, что во многих случаях муравьи мономера актина как «кэп» предотвращает удлинение F-актина.
ACTA1 - это ген, который кодирует изоформу α- актина, который преобладает в скелетно-полосатых мышцах человека, хотя он также экспрессируется в сердечной мышце и в щитовидной железе. Его последовательность ДНК состоит из семи экзонов, производящих пять известных транскриптов. Большинство из них состоят из точечных мутаций, вызывающих замену аминокислот. Мутации во многих случаях связаны с фенотипом, который определяет серьезность и недуга.
Гигантские немалиновые стержни, полученные в результате трансфекции последовательность ДНК из ACTA1, которая является носителем мутации, ответственной за миопатию немалинаМутация изменяет и функцию скелетных мышц, вырабатывающих такую трех форм миопатии : 3-го типа немалиновая миопатия, врожденная миопатия с избытком тонких миофиламентов (CM) и врожденная миопатия сропорцией типов (CMFTD). Также были обнаружены мутации, вызывающие основные миопатии. Хотя их фенотипы схожи, в дополнение к типичной немалиновой миопатии некоторые специалисты выделяют другой тип миопатии, называемый актинической немалиновой миопатией. В первом случае вместо обычных палочек образуются сгустки актина. Важно указать, что пациент может показать более одного из этих фенотипов в биопсии. Наиболее частые симптомы включают типичную морфологию лица (миопатическое facies ), мышечную слабость, задержку моторного развития и затрудненное дыхание. Течение болезни, ее тяжесть и возраст, в котором она проявляется, являются вариабельными, совпадают совпадающие формы миопатии. Симптомом немалиновой миопатии является то, что немалиновые стержни появляются в разных местах мышечных волокон 1 типа. Эти стержни не- патогномоничные структуры, которые имеют состав, подобный Z-дискам, обнаруженным в саркомере.
. Патогенез этой миопатии очень разнообразен. Многие мутации происходят в области вдавливания актина с его сайтами связывания нуклеотидов, тогда как происходит взаимодействие с ассоциированными белками. Это каким-то образом объясняет большое разнообразие сгустков, которые образуются в этих случаях, таких как немалин, внутриядерные тела или тела зебры. Изменения в сворачивании актина происходят при немалиновой миопатии, а также изменения в его агрегации, а также есть изменения в экспрессии других ассоциированных белков. В некоторых вариантах, где обнаруживаются внутриядерные тельца, изменения в сворачивании маскируют сигнал ядра ядра , так что накопление мутированной формы актина происходит в ядре клетки. С другой стороны, похоже, что мутации ACTA1, которые вызывают CFTDM, оказывают большее влияние на саркомерную функцию, чем на ее структуру. Недавние исследования пытались понять этот очевидный парадокс, который предполагает, что нет четкой корреляции между стержней и мышечной слабостью. Похоже, что некоторые мутации могут вызвать более высокую скорость апоптоза в мышечных волокнах типа II.
Расположение семи мутаций, относящихся к различным актинопатиям, относящихся к ACTA1Есть две изоформы, которые кодируют актины в гладкой мышечной ткани :
ACTG2 кодирует самую большую изоформу актина, которая имеет девять экзонов, один из которых находится на конце 5 ', не переведен на. Это γ-актин, экспрессируется в гладкой кишке. Не обнаружено мутаций этого гена, соответствующих патологий, хотя микипы показали, что этот белок чаще экспрессируется в устойчивых к химиотерапии с использованием цисплатина.
ACTA2 кодирует α- актинцах, расположенных в гладких мышцах, а также в гладких мышцах. Было вызвано, что мутация MYH11 может быть причиной по крайней мере 14% наследственных аневризм грудной аорты, особенно типа 6. Это связано с тем, что мутированный вариант вызывает неправильную нитевидную сборку и снижает способность гладких мышц сосудов. сокращение. У этих людей была деградация среды аорты с зонами дезорганизации и гиперплазией, а также стенозом аорты vasa vasorum. Число болезней, которые связаны в этот ген, увеличиваются. Это было связано с болезнью Моямоя, и вполне вероятно, что мутации в гетериготном состоянии вызывают предрасположенность ко многим сосудистым патологиям, таким как аневризм грудной аорты и ишемическая болезнь сердца. Α-актин, обнаруженный в гладких мышцах, также является интересным маркером для оценки развития печени цирроза.
Ген ACTC1 кодирует α-актин. изоформа присутствует в сердечной мышце. Впервые он был секвенирован Хамадой и сотрудниками в 1982 году, когда было обнаружено, что он прерывается пятью интронами. Были обнаружены аллели, связанные с процессами в патологических процессах.
Поперечное сечение рат сердца, которое показывает признаки дилатационной кардиомиопатииОписан ряд структурных нарушений, связанных с точечными мутациями этого гена, вызывающих нарушение работы таких сердца, как дилатационная кардиомиопатия типа 1R и гипертрофическая кардиомиопатия типа 11 . Некоторые дефекты межпредсердной перегородки были развиты, которые также связаны с этими мутациями.
Были изучены два случая дилатационной кардиомиопатии с заменой высококонсервативных аминокислот, принадлежащих к доменам белка, которые связываются и перемежаются с Z-дисками. Это привело к теории, что дилатация вызывается дефектом передачи сократительной силы в миоцитах.
. Мутации в ACTC1 вызывают по меньшей мере 5% кардиомиопатий. Также было обнаружено точечных мутаций:
Патогенез, по-видимому, включает компенсаторный механизм: мутировавшие белки как токсины с доминирующим, снижающая способность сердца сокращаться, вызывая аномальное механическое поведение, такое, что гипертрофия, обычно отсроченная, следствие нормальной генерации сердечной мышцы на стресс.
Недавние исследования мутации ACTC1, участвуют в двух других патологических процессах: Инфантильная идиопатическая рестриктивная кардиомиопатия и некомпакция миокарда левого желудочка.
ACTB представляет собой очень сложный локус. Существует псевдогенов, которые могут быть распределены по геному, и его последовательность состоит из шести экзонов, которые могут давать до 21 различных транскрипций посредством альтернативного сплайсинга, которые известны как β - актины. В соответствии с этой сложностью его продукты также широко используются в различных местах (цитоскелет, NuA4 комплекс гистон -ацилтрансфераза, клетка ядро ) и, кроме того, они связаны с механизмом большого количества патологических процессов (карциномы, ювенильная дистония, механизмы инфекции, среди нервной системы, пороки развития и опухолевые инвазии, опухолевые инвазии и прочее). Была открыта новая форма актина, каппа-актин, которая, по-видимому, заменяет β-актин в процессах, связанных с опухолями.
Изображение, полученное с помощью конфокальной микроскопии и с конкретными антитела, показывающие кортикальную сеть актина. Подобно тому, как при ювенильной дистонии происходит нарушение структур цитоскелета, в данном случае он продуцируется цитохалазином D.Три патологических процесса: до сих пор было обнаружено, что они вызваны прямое изменение последовательности гена:
Локус ACTG1 кодирует цитозольный белок γ-актина, который отвечает за образование цитоскелетных микрофиламентов. Он содержит шесть экзонов, дающих начало 22 различных мРНК <четыре306>, которые производят полных изоформы, форма экспрессии которых, вероятно, зависит от типа ткани., в котором они обнаружены. Он также имеет два разных ДНК-промотора. Эта локуса и из локуса β-актина, очень похожи на предсказанные, что предполагает общую предковую последовательность, которая предполагает дупликацию и генетическую конверсию.
С точки зрения патологии, это связано с такими процессами, как амилоидоз, пигментный ретинит, механизмы инфекции, заболевания почек и различных типов врожденной потери слуха.
Было обнаружено, что шесть аутосомно-доминантных точечных мутаций выполняет эти виды испытаний, в частности, нейросенсорную тугоухость, связанную с локусом DFNA 20/26. Похоже, они влияют на стереоцилии реснитчатых клеток, присутствующих в кортиевом органе внутреннего уха. β-актин является наиболее распространенным белком в тканях человека, но его не так много в реснитчатых клетках, который объясняет локализацию патологии. Другие стороны, участвующие в исследованиях других мутаций, участвуют в исследованиях других белков, особенно с актомиозином. Некоторые эксперименты предполагают, что патологический механизм этого типа связан с тем, что F-актин в мутациях более чувствителен к кофилину, чем обычно.
Однако, если нет никаких записей в каком-либо случае, это известно, что γ-актин также экспрессируется в скелетных мышцах, и, хотя он присутствует в небольших количествах, модельные организмы показали, что его отсутствие может вызвать миопатии.
Некоторые инфекционные агенты используют актин, особенно цитоплазматический актин, в своем жизненном цикле. Две основные формы присутствуют в бактериях :
В дополнение к ранее процитированному примеру, полимеризация актина стимулирует на начальных этапах интернализации некоторых, в частности ВИЧ, например, путем инактивации комплекса кофилина.
Роль, которую актин играет в процессе инвазии раковых клеток, до сих пор не определена.
Эукариотический цитоскелет организмов из всех таксономических групп имеет компоненты, аналогичные актину и тубулину. Например, белок, кодируемый геном ACTG2 у человека, полностью эквивалентен гомологам, присутствующим у крыс и мышей, даже если на уровне нуклеотидов сходство снижается до 92%. Однако есть различия с компонентами в прокариотах (FtsZ и MreB ), где сходство между нуклеотидными последовательностями составляет 40-50% у разных бактерий и архей видов. Некоторые авторы предполагают, что предковый белок, который дал начало модельному эукариотическому актину, похож на белки, присутствующие в современных бактериальных цитоскелетах.
Структура MreB, бактериального белка, трехмерная структура которого напоминает структуру G-актинНекоторые отмечают, что поведение актина, тубулина и гистона, белка, участвующего в стабилизации и регуляции ДНК, сходно по их способности связывать нуклеотиды и по их способности захватывать преимущественно броуновского движения. Также было высказано предположение, что все они общего предка. Таким образом, эволюционные процессы сегодня приводят к диверсификации предковых до разновидностей, вызывая, с сохранением, среди прочего, актинов как эффективных молекул, способных справляться с важными наследственными биологическими процессами, такими как эндоцитоз.
бактериальный цитоскелет может быть не таким сложным, как у эукариот ; однако он содержит белки, которые очень похожи на мономеры и полимеры актина. Бакальный белок MreB полимеризуется в тонких неспиральных филаментах, а иногда и в спиральных структурах, подобных F-актину. Более того, его кристаллическая структура очень похожа на структуру G-актина (с точки зрения его трехмерной конформации), есть даже сходства между протофиламентами MreB и F-актином. Бактериальный цитоскелет также содержит белки FtsZ, которые похожи на тубулин.
Бактерии, следовательно, обладают цитоскелетом с элементами, гомологичными актину (например, MreB, AlfA, ParM, FtsA и MamK), даже если аминокислотная последовательность этих белков отличается от присутствующей в клетках животных. Однако такие белки имеют высокую степень структурного ства с эукариотическим актином. Высокодинамичные микрофиламенты, образованные агрегацией MreB и ParM необходимы для жизнеспособности клеток, они участвуют в морфогенезе, сегрегации хромосомы и полярности клеток. ParM является гомологом актина, который кодируется в плазмиде и участвует в регуляции плазмидной ДНК. ParMs из разных бактериальных плазмид могут образовывать удивительно разнообразные спиральные структуры, содержащие две или четыре цепи, чтобы поддерживать точное наследование плазмид.
Актин используется в научных и технологических лабораториях как трек для молекулярных двигателей, таких как миозин (в мышечной ткани или вне ее), и как необходимый компонент для клеточного функционирования. Его также можно использовать в качестве диагностического инструмента, так как несколько его аномальных вариантов связаны с появлением конкретных патологий.
Использование актина в качестве внутреннего контроля основано на предположении, что его экспрессия практически постоянна и не зависит от условий эксперимента. Сравнивая экспрессию интересующего гена с экспрессией актина, можно получить относительную величину, которую можно сравнивать в разных экспериментах, если экспрессия последнего постоянна. Стоит отметить, что актин не всегда имеет желаемую стабильность в экспрессии его гена .
Гены человека, кодирующие белки актина, включают: