 Функция белков каркаса
Функция белков каркаса В биологии белки каркаса являются решающими регуляторами многих ключевых сигнальных путей. Хотя каркасы строго не определены по функциям, известно, что они взаимодействуют и / или связываются с множеством членов сигнального пути, связывая их в комплексы. В таких путях они регулируют передачу сигнала и помогают локализовать компоненты пути (организованные в комплексы) в определенных областях клетки, таких как плазматическая мембрана, цитоплазма, ядро, Гольджи, эндосомы и митохондрии.
Первым обнаруженным сигнальным каркасным белком был белок Ste5 дрожжей Saccharomyces cerevisiae. Было показано, что три отдельных домена Ste5 связаны с протеинкиназами и Fus3 с образованием мультикиназного комплекса.
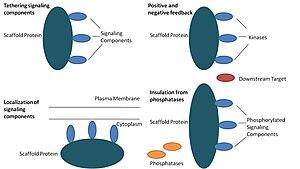
Белки каркаса действуют по крайней мере четырьмя способами: привязка сигнальных компонентов, локализация этих компонентов в определенных областях клетки, регулирование передачи сигналов путем координации положительных и отрицательных сигналов обратной связи и изоляция правильных сигнальных белков от конкурирующих
Эта конкретная функция считается самой основной функцией каркаса. Каркасы собирают сигнальные компоненты каскада в комплексы. Эта сборка может быть способна повышать специфичность передачи сигналов, предотвращая ненужные взаимодействия между белками передачи сигналов, и повышать эффективность передачи сигналов путем увеличения близости и эффективной концентрации компонентов в комплексе каркаса. Распространенным примером того, как каркасы повышают специфичность, является каркас, который связывает протеинкиназу и ее субстрат, обеспечивая тем самым специфическое фосфорилирование киназы. Кроме того, некоторые сигнальные белки требуют множественных взаимодействий для активации, и привязка каркаса может быть способна преобразовывать эти взаимодействия в одно взаимодействие, которое приводит к множественным модификациям. Каркасы также могут быть каталитическими, поскольку взаимодействие с сигнальными белками может приводить к аллостерическим изменениям этих сигнальных компонентов. Такие изменения могут усиливать или ингибировать активацию этих сигнальных белков. Примером является каркас Ste5 в пути митоген-активируемой протеинкиназы (MAPK ). Предполагается, что Ste5 направляет передачу сигналов спаривания через Fus3 MAPK путем каталитического разблокирования этой конкретной киназы для активации ее MAPKK Ste7.
Каркасы локализуют сигнальную реакцию в клетке. специфическая область в клетке, процесс, который может быть важен для местного производства сигнальных промежуточных продуктов. Конкретным примером этого процесса является каркас, якорные белки A-киназы (AKAP), которые нацелены на циклическую AMP-зависимую протеинкиназу (PKA ) в различные участки клетки. Эта локализация способна локально регулировать PKA и приводит к локальному фосфорилированию PKA ее субстратов.
Многие гипотезы о том, как скаффолды координируют положительную и отрицательную обратную связь, исходят из инженерных структур и математического моделирования. В сигнальных каскадах трех киназ каркасы связывают все три киназы, повышая специфичность киназы и ограничивая амплификацию сигнала за счет ограничения фосфорилирования киназы только одной нижерасположенной мишенью. Эти способности могут быть связаны со стабильностью взаимодействия между каркасом и киназами, основной активностью фосфатазы в клетке, расположением каркаса и уровнями экспрессии сигнальных компонентов.
Сигнальные пути часто инактивируются ферментами, которые изменяют состояние активации и / или вызывают деградацию сигнальных компонентов. Были предложены каркасы для защиты активированных сигнальных молекул от инактивации и / или деградации. Математическое моделирование показало, что киназы в каскаде без каркасов имеют более высокую вероятность дефосфорилирования фосфатазами еще до того, как они смогут фосфорилировать нижестоящие мишени. Кроме того, было показано, что каркасы изолируют киназы от субстрат- и АТФ-конкурентных ингибиторов.
| Каркасные белки | Путь | Возможные функции | Описание |
|---|---|---|---|
| KSR | MAPK | Сборка и локализация пути RAS-ERK | Одним из наиболее изученных сигнальных путей в биологии является RAS-ERK путь, в котором G-белок RAS активирует MAPKKK RAF, который активирует MAPKK MEK1 (MAPK / ERK киназу 1), который затем активирует MAPK ERK. Было идентифицировано несколько каркасных белков, участвующих в этом пути и других подобных путях MAPK. Одним из таких каркасных белков является KSR, который является наиболее вероятным эквивалентом хорошо изученного дрожжевого каркасного белка Ste5 MAPK. Он является положительным регулятором пути и связывает многие белки этого пути, включая все три киназы в каскаде. Было показано, что KSR локализуется на плазматической мембране во время активации клетки, тем самым играя роль в сборке компонентов пути ERK и в локализации активированной ERK на плазматической мембране. |
| MEKK1 | MAPK | Сборка и локализация сигнаносомы рецептора смерти | Другие белки каркаса включают B-клеточную лимфому 10 (BCL-10 ) и киназу MEK 1 (MEKK1 ), которые играют роль в пути N-концевой киназы JUN (JNK ). |
| BCL-10 | MAPK | Сборка и специфичность JNK | |
| AKAP | PKA Пути | Координация фосфорилирования PKA по нижестоящим мишеням | Это семейство белков связано только структурно по их способности связывать регуляторную субъединицу PKA, но в остальном может связывать очень разнообразный набор ферментов и субстратов |
| AHNAK-1 | Передача сигналов кальция | Сборка и локализация кальциевых каналов | Передача сигналов кальция необходима для правильного функционирования иммунных клеток. Недавние исследования показали, что каркасный белок, AHNAK1, важен для эффективной передачи сигналов кальция и активации NFAT в Т-клетках благодаря его способности правильно локализовать кальциевые каналы на плазматической мембране [14]. Также было показано, что в неиммунных клетках AHNAK1 связывает кальциевые каналы с фосфолипазой Cγ (PLC-γ ) и PKC. Связывающие кальций белки часто подавляют большую часть поступающего кальция, поэтому связывание этих эффекторов кальция может быть особенно важным, когда сигналы индуцируются слабым притоком кальция. |
| HOMER | Передача сигналов кальция | Ингибирование активации NFAT | Другим примером каркасного белка, который модулирует передачу сигналов кальция, являются белки семейства HOMER. Было показано, что белки HOMER конкурируют с кальциневрином за связывание с N-концом NFAT в активированных Т-клетках. Благодаря этой конкуренции белки HOMER способны снижать активацию NFAT, что также снижает выработку цитокина IL-2. Напротив, было показано, что белки HOMER положительно регулируют передачу сигналов кальция в нейронах, связывая рецептор глутамата с рецепторами трифосфата в эндоплазматическом ретикулуме. |
| Пеллино | Врожденная иммунная передача сигналов | Сборка сигнаносомы TLR | Существуют доказательства того, что белки пеллино функционируют как каркасные белки в важном сигнальном пути врожденного иммунитета, пути Toll-подобного рецептора (TLR ). Во многом функция Пеллино является предположением; однако белки Pellino могут связываться с IRAK1, TRAF6 и TAK1 после активации IL-1R, что указывает на то, что они могут собирать и локализовать компоненты пути TLR рядом с его рецептором. |
| Врожденная иммунная сигнализация | Сборка Инфламмасома | Семейство NLR представляет собой высококонсервативное и большое семейство рецепторов, участвующих в врожденном иммунитете. Семейство рецепторов NLRP (семейство NLR, содержащие пириновый домен) функционируют как каркасы, собирая инфламмасому, комплекс, который приводит к секреции провоспалительных цитокинов, таких как IL-18 и IL-1β. | |
| DLG1 | Т-клеточный рецептор передача сигналов | Сборка и локализация сигнальных молекул TCR, активация p38 | DLG1 высококонсервативна в иммунных клетках и важна для активации Т-клеток на периферии. Он рекрутируется в иммунологический синапс и связывает ζ-цепь Т-клеточного рецептора (TCR ) с CBL, WASP, p38, LCK, VAV1 и ZAP70. Эти данные свидетельствуют о том, что DLG1 играет роль в связывании сигнального аппарата TCR с регуляторами цитоскелета, а также предполагает роль в альтернативной активации пути p38. Однако неясно, регулирует ли DLG1 положительно или отрицательно активацию Т-клеток. |
| Спинофилин | Дендритная клетка Передача сигналов | Сборка белков иммунологического синапса DC | Спинофилин участвует в функции дендритных клеток, в частности, в образовании иммунологические синапсы. Спинофилин рекрутируется в синапс после контакта дендритных клеток с Т-клетками. Этот набор кажется важным, потому что без спинофилина дендритные клетки не могут активировать Т-клетки in vitro или in vivo. Как спинофилин способствует презентации антигена в этом случае, до сих пор неизвестно, хотя возможно, что спинофилин регулирует продолжительность контакта клетки в синапсе или регулирует рециркуляцию костимулирующих молекул в клетке, таких как молекулы MHC. |
| Регулирующий белок гриппа растений | Координация отрицательной обратной связи во время биосинтеза протохлорофиллида. | Сборка и локализация пути, который включает синтез высокотоксичного протохлорофиллида, предшественника хлорофилла. | Синтез протохлорофиллида должен строго регулироваться, поскольку для его превращения в хлорофилл требуется свет. Регуляторный белок FLU расположен в тилакоидной мембране и содержит только несколько сайтов белок-белкового взаимодействия без каталитической активности. Мутанты, лишенные этого белка, накапливают протохлорофиллид в темноте. Партнеры по взаимодействию неизвестны. В ходе эволюции белок претерпел упрощение. |
Белок Хантингтин локализуется совместно с репарационным белком ATM на сайтах повреждения ДНК. Хантингтин представляет собой каркасный белок в комплексе реакции на окислительное повреждение ДНК ATM. Пациенты с болезнью Хантингтона с аберрантным белком хантингтина испытывают дефицит в восстановлении окислительного повреждения ДНК. Окислительное повреждение ДНК, по-видимому, лежит в основе патогенеза болезни Гентингтона. Болезнь Хантингтона, вероятно, вызвана дисфункцией мутантного каркасного белка хантингтина в репарации ДНК, что приводит к увеличению окислительного повреждения ДНК в метаболически активных клетках.
В некоторых других случаях в биологии (не обязательно в отношении передачи сигналов клеток) термин «каркасный белок» используется в более широком смысле, когда белок объединяет несколько вещей для любых целей.