Миграция клеток - центральный процесс в развитии и поддержании многоклеточных организмов. Формирование ткани во время эмбрионального развития, заживления ран и иммунных ответов требует согласованного движения клеток в определенных направлениях в определенные места. Клетки часто мигрируют в ответ на определенные внешние сигналы, включая химические сигналы и механические сигналы. Ошибки во время этого процесса имеют серьезные последствия, включая умственную отсталость, сосудистые заболевания, образование опухоли и метастазы. Понимание механизма миграции клеток может привести к разработке новых терапевтических стратегий для контроля, например, инвазивных опухолевых клеток.
Из-за высокой вязкости окружающей среды (низкое число Рейнольдса ) клеткам необходимо постоянно создавать силы, чтобы двигаться. Клетки достигают активного движения с помощью самых разных механизмов. Многие менее сложные прокариотические организмы (и сперматозоиды) используют жгутики или реснички, чтобы продвигаться вперед. Миграция эукариотических клеток обычно намного сложнее и может состоять из комбинации различных механизмов миграции. Обычно это связано с резкими изменениями формы клеток, которые вызваны цитоскелетом. Два очень разных сценария миграции - это движение ползанием (наиболее часто изучаемое) и подвижность пузырей. Парадигматический пример ползания - случай эпидермальных кератоцитов рыб, которые широко использовались в исследованиях и обучении.
Миграцию культивируемых клеток, прикрепленных к поверхности или в 3D, обычно изучают с помощью микроскопии. Поскольку движение клеток очень медленное, для ускорения движения записывают видео с покадровой микроскопией мигрирующих клеток со скоростью несколько мкм / мин. Такие видеоролики (рис. 1) показывают, что передний фронт клетки очень активен, с характерным поведением последовательных сокращений и расширений. Принято считать, что передний фронт - это главный двигатель, который тянет ячейку вперед.
Считается, что процессы, лежащие в основе миграции клеток млекопитающих, согласуются с процессами (не сперматозоической ) локомоции. Общие наблюдения включают:
Последняя особенность наиболее легко наблюдается при скоплении поверхности молекулы перекрестно сшиваются с флуоресцентным антителом или когда маленькие шарики искусственно связываются с передней частью клетки.
Другие эукариотические клетки мигрируют аналогичным образом. Амеба Dictyostelium discoideum полезна для исследователей, поскольку они постоянно демонстрируют хемотаксис в ответ на циклический АМФ ; они движутся быстрее, чем культивируемые клетки млекопитающих; и у них есть гаплоидный геном, который упрощает процесс связывания определенного генного продукта с его влиянием на поведение клетки.
 Две разные модели движения клеток. А) Модель цитоскелета. B) Модель мембранного потока
Две разные модели движения клеток. А) Модель цитоскелета. B) Модель мембранного потока  (A) Динамические микротрубочки необходимы для втягивания хвоста и распределяются на заднем конце мигрирующей клетки. Зеленые высокодинамичные микротрубочки; желтые, умеренно динамические микротрубочки и красные, стабильные микротрубочки. (B) Стабильные микротрубочки действуют как распорки и предотвращают втягивание хвоста и тем самым препятствуют миграции клеток.
(A) Динамические микротрубочки необходимы для втягивания хвоста и распределяются на заднем конце мигрирующей клетки. Зеленые высокодинамичные микротрубочки; желтые, умеренно динамические микротрубочки и красные, стабильные микротрубочки. (B) Стабильные микротрубочки действуют как распорки и предотвращают втягивание хвоста и тем самым препятствуют миграции клеток. Существуют две основные теории того, как клетка продвигается по своему переднему краю: модель цитоскелета и мембрана модель потока. Возможно, что оба основных процесса способствуют расширению клеток.
Эксперименты показали, что на переднем крае клетки происходит быстрая полимеризация актина. Это наблюдение привело к гипотезе, что образование актиновых филаментов "толкает" передний край вперед и является основной движущей силой для продвижения переднего края клетки. Кроме того, элементы цитоскелета способны широко и тесно взаимодействовать с плазматической мембраной клетки.
Другие компоненты цитоскелета (например, микротрубочки) выполняют важные функции в миграции клеток. Было обнаружено, что микротрубочки действуют как «распорки», которые противодействуют сократительным силам, которые необходимы для ретракции заднего края во время движения клетки. Когда микротрубочки на заднем крае клетки динамичны, они способны ремоделироваться, чтобы позволить ретракцию. Когда динамика подавлена, микротрубочки не могут реконструироваться и, следовательно, противодействуют сократительным силам. Морфология клеток с подавленной динамикой микротрубочек указывает на то, что клетки могут расширять передний край (поляризованный в направлении движения), но испытывают трудности с отводом своего заднего края. С другой стороны, высокие концентрации лекарств или мутации микротрубочек, которые деполимеризуют микротрубочки, могут восстановить миграцию клеток, но при этом происходит потеря направленности. Можно сделать вывод, что микротрубочки действуют как для ограничения движения клеток, так и для установления направленности.
Исследования также показали, что фронт миграции - это место, где мембрана возвращается на поверхность клетки из пулов внутренних мембран в конце эндоцитарный цикл. Это привело к гипотезе о том, что расширение переднего края происходит в основном за счет добавления мембраны в передней части клетки. Если это так, то актиновые филаменты, которые образуются спереди, могут стабилизировать добавленную мембрану, так что формируется структурированное расширение или ламелла, а не пузырьковая структура (или пузырек) на ее передней части. Чтобы клетка могла двигаться, необходимо вывести вперед свежий запас «ступней» (белков, называемых интегринами, которые прикрепляют клетку к поверхности, по которой она ползет). Вероятно, что эти ножки эндоцитозируются по направлению к задней части клетки и перемещаются к передней части клетки посредством экзоцитоза, чтобы повторно использовать их для образования новых прикреплений к субстрату.
 Обратный мембранный поток (красные стрелки) и перемещение пузырьков от задней части к передней (синие стрелки) приводят к миграции, не зависящей от адгезии.
Обратный мембранный поток (красные стрелки) и перемещение пузырьков от задней части к передней (синие стрелки) приводят к миграции, не зависящей от адгезии. Ползание по адгезиву - не единственный показанный способ миграции эукариотическими клетками. Важно отметить, что метастатические раковые клетки и иммунные клетки, такие как макрофаги и нейтрофилы, как было обнаружено, способны к независимой от адгезии миграции. Механистическая основа этого способа миграции менее понятна, чем ползание эукариотических клеток или плавание микроорганизмов на основе жгутиков. Физик Э. М. Перселл предположил, что в условиях гидродинамики с низким числом Рейнольдса, которые применяются в клеточном масштабе, обратный поверхностный поток может обеспечить механизм, позволяющий микроскопическим объектам плыть вперед. Спустя несколько десятилетий эта модель была экспериментально подтверждена с помощью оптогенетики. Было показано, что клетки, мигрирующие амебоидным образом без адгезии, демонстрируют поток плазматической мембраны в направлении задней части клетки, который может продвигать клетки, оказывая касательные силы на окружающую жидкость. Поляризованный перенос содержащих мембраны везикул от задней части клетки к передней помогает поддерживать размер клетки. Обратный мембранный ток также наблюдался в клетках Dictyostelium discoideum. Интересно, что миграция надклеточных кластеров также поддерживается аналогичным механизмом обратного поверхностного потока.
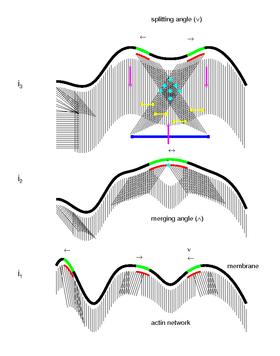 Схематическое изображение коллективного биомеханического и молекулярного механизма движения клеток
Схематическое изображение коллективного биомеханического и молекулярного механизма движения клеток Основываясь на некоторых математических моделях, недавние исследования выдвигают гипотезу о новой биологической модели коллективного биомеханического и молекулярного механизма движения клеток. Предполагается, что микродомены плетут структуру цитоскелета, и их взаимодействия отмечают место для образования новых сайтов адгезии. Согласно этой модели, динамика передачи сигналов микродоменов организует цитоскелет и его взаимодействие с субстратом. Поскольку микродомены запускают и поддерживают активную полимеризацию актиновых филаментов, их распространение и зигзагообразное движение по мембране создают сильно взаимосвязанную сеть изогнутых или линейных филаментов, ориентированных под широким спектром углов к границе клетки. Также предполагается, что взаимодействие микродоменов отмечает образование новых очаговых участков адгезии на периферии клетки. Взаимодействие миозина с сетью актина затем создает втягивание / взъерошивание мембраны, ретроградный поток и сократительные силы для движения вперед. Наконец, постоянное воздействие на старые очаговые адгезии может привести к индуцированной кальцием активации кальпаина и, следовательно, к отслоению очаговых спаек, завершающему цикл.
Мигрирующие клетки имеют полярность - переднюю и заднюю. Без него они двигались бы сразу во всех направлениях, т.е. Как эта полярность формулируется на молекулярном уровне внутри клетки, неизвестно. В ячейке, которая извивается случайным образом, фронт может легко уступить место пассивному, поскольку какая-то другая область или области ячейки образуют новый фронт. В хемотаксирующих клетках стабильность фронта, по-видимому, увеличивается по мере того, как клетка продвигается к более высокой концентрации стимулирующего химического вещества. Эта полярность отражается на молекулярном уровне ограничением определенных молекул определенными участками внутренней клеточной поверхности. Таким образом, фосфолипид PIP3 и активированный Rac и CDC42 находятся в передней части клетки, тогда как Rho GTPase и PTEN обнаруживаются в сторону задней части.
Считается, что нитчатые актины и микротрубочки важны для установления и поддержания полярности клетки. Лекарства, разрушающие актиновые филаменты, обладают множественными и сложными эффектами, отражающими широкую роль, которую эти филаменты играют во многих клеточных процессах. Возможно, что как часть локомоторного процесса мембранные везикулы транспортируются по этим филаментам к передней части клетки. В хемотаксирующих клетках повышенная устойчивость миграции к мишени может быть результатом повышенной стабильности расположения нитевидных структур внутри клетки и определять ее полярность. В свою очередь, эти нитевидные структуры могут быть расположены внутри клетки в соответствии с тем, как молекулы, подобные PIP3 и PTEN, расположены на внутренней клеточной мембране. А их расположение, в свою очередь, определяется сигналами хемоаттрактантов, поскольку они воздействуют на специфические рецепторы на внешней поверхности клетки.
Хотя известно, что микротрубочки влияют на миграцию клеток в течение многих лет, механизм, с помощью которого они это делают, остается спорным. На плоской поверхности микротрубочки не нужны для движения, но они необходимы для обеспечения направленности движения клеток и эффективного выступа переднего края. Когда они присутствуют, микротрубочки замедляют движение клеток, когда их динамика подавляется медикаментозным лечением или мутациями тубулина.
Область исследований, называемая обратными проблемами в подвижности клеток. Этот подход основан на идее, что изменения поведения или формы клетки несут информацию о лежащих в основе механизмах, которые вызывают эти изменения. Чтение движения клеток, а именно понимание лежащих в основе биофизических и механохимических процессов, имеет первостепенное значение. Математические модели, разработанные в этих работах, определяют некоторые физические характеристики и свойства материала клеток локально посредством анализа последовательностей изображений живых клеток и используют эту информацию для дальнейших выводов о молекулярных структурах, динамике и процессах внутри клеток, таких как актин. сеть, микродомены, хемотаксис, адгезия и ретроградный поток.