| Удельная энергия | 40,104,000 J /kg (теоретическая) |
|---|---|
| Плотность энергии | ? J /m³ |
| Удельная мощность | 11400 W /kg |
| Номинальное напряжение элемента | 2,91 V |
Литий-воздушная батарея (Li-air ) химия металл-воздушный электрохимический элемент или батарея, в которой используется окисление лития лития на аноде и восстановление кислорода на катоде, чтобы вызвать прохождение тока.
Соединение лития и кислорода окружающей среды теоретически может привести к электрохимическим ячейкам с максимально возможной удельной энергия. Действительно, теоретическая удельная энергия неводной литий-воздушной батареи в заряженном состоянии с продуктом Li2O2 и без учета массы кислорода составляет ~ 40,1 МДж / кг. Это сопоставимо с теоретической удельной энергией бензина ~ 46,8 МДж / кг. На практике были продемонстрированы литий-воздушные батареи с удельной энергией ~ 6,12 МДж / кг на уровне элементов. Это примерно в 5 раз больше, чем у серийного литий-ионного аккумулятора, и его достаточно для пробега 2000 кг EV на расстояние ~ 500 км (310 миль) на одной зарядке при 60 кг батарей. Однако практическая мощность и срок службы литий-воздушных батарей нуждаются в значительных улучшениях, прежде чем они смогут занять рыночную нишу.
Для коммерческого внедрения необходимы значительные усовершенствования в области электролитов. Активны четыре подхода: апротонный, водный, твердотельный и смешанный водно-апротонный.
Металло-воздушные батареи, в частности цинк – воздух, привлекли внимание из-за потенциально высокой плотности энергии. Теоретические удельные плотности энергии для металл-воздушных батарей выше, чем для ионных методов. Литий-воздушные батареи теоретически могут достигать 3840 мА · ч / г.
Основным драйвером рынка аккумуляторов является автомобильный сектор. Плотность энергии бензина составляет примерно 13 кВт · ч / кг, что соответствует 1,7 кВт · ч / кг энергии, передаваемой колесам после потерь. Теоретически литий-воздух может достигать 12 кВт · ч / кг (43,2 МДж / кг) без учета массы кислорода. С учетом веса полной аккумуляторной батареи (корпус, воздушные каналы, литиевая подложка), хотя сам литий очень легкий, удельная энергия значительно ниже.
Литий-воздушная батарея потенциально имела 5–15 раз больше. удельная энергия литий-ионной батареи по состоянию на 2016 год.
Первоначально предложенный в 1970-х годах в качестве возможного источника энергии для аккумуляторных электромобилей и гибридных электромобилей, Литий-воздушные батареи вновь привлекли научный интерес в конце первого десятилетия 2000-х годов благодаря е в материаловедении.
Хотя идея литий-воздушной батареи возникла задолго до 1996 года, соотношение риска и пользы было воспринято как слишком высокое, чтобы его можно было реализовать. Действительно, как отрицательный (металлический литий), так и положительный (воздушный или кислородный) электроды являются причинами, по которым, соответственно, перезаряжаемые литий-металлические батареи не смогли выйти на рынок в 1970-х годах (литий-ионный аккумулятор в мобильном устройстве использует LiC 6 -графитовое соединение на отрицательном электроде, а не металлический литий). Тем не менее, из-за предполагаемого отсутствия других альтернатив перезаряжаемым батареям с высокой удельной энергией и из-за некоторых первоначально многообещающих результатов академических лабораторий, как количество патентов, так и публикаций в свободной области, связанных с литий-кислородным (включая Li-воздух) Аккумуляторы начали экспоненциально расти в 2006 году. Однако технические трудности, с которыми сталкиваются такие аккумуляторы, особенно время перезарядки, чувствительность к азоту и воде, а также низкая проводимость заряженных частиц Li 2O2являются серьезными проблемами.
 Схема циклов заряда и разряда литий-воздушной батареи
Схема циклов заряда и разряда литий-воздушной батареи Обычно ионы лития перемещаются между анодом и катодом через электролит. При разряде электроны следуют за внешней цепью для выполнения электрической работы, а ионы лития мигрируют к катоду. Во время загрузки пластины металлического лития на анод, высвобождая O. 2на катоде. Рассмотрены как неводные (с Li 2O2или LiO 2 в качестве продуктов разряда), так и водные (LiOH в качестве продукта разряда) Li-O 2. Аккумулятор на водной основе требует защитного слоя на отрицательном электроде, чтобы металл Li не вступал в реакцию с водой.
 Схема искусственной и спонтанной границы раздела электролитов
Схема искусственной и спонтанной границы раздела электролитов Металлический литий является типичным выбором анода. На аноде электрохимический потенциал заставляет металлический литий выделять электроны посредством окисления (без участия катодного кислорода). Половина реакции:
Литий имеет высокую удельную емкость (3840 мАч / г) по сравнению с другими материалами металл-воздушной батареи (820 мАч / г для цинка, 2965 мАч / г для алюминий ). На такие клетки влияет несколько проблем. Основная проблема при разработке анода - предотвратить реакцию анода с электролитом. Альтернативы включают новые материалы электролита или изменение интерфейса между электролитом и анодом. Литиевые аноды рискуют дендритными отложениями лития, снижая энергоемкость или вызывая короткое замыкание. Влияние размера пор и распределения пор по размерам остается плохо изученным.
При зарядке / разряде в апротонных ячейках слои солей лития осаждаются на аноде, в конечном итоге покрывая его и создавая барьер между литием и электролитом. Этот барьер первоначально предотвращает коррозию, но в конечном итоге тормозит кинетику реакции между анодом и электролитом. Это химическое изменение границы раздела твердое тело-электролит (SEI) приводит к изменению химического состава по всей поверхности, что приводит к соответствующему изменению тока. Неравномерное распределение тока способствует росту ветвящихся дендритов и обычно приводит к короткому замыканию между анодом и катодом.
В водных ячейках проблемы в SEI возникают из-за высокой реакционной способности металлического лития с водой.
Несколько подходов пытаются преодолеть эти проблемы:
На катоде во время зарядки кислород отдает электроны литию посредством восстановления. Мезопористый углерод использовался в качестве катодной подложки с металлическими катализаторами, которые улучшают кинетику восстановления и увеличивают удельную емкость катода. Марганец, кобальт, рутений, платина, серебро или смесь кобальта и марганца являются потенциальными металлическими катализаторами. При некоторых обстоятельствах катоды, катализируемые марганцем, работали лучше всего, с удельной емкостью 3137 мА · ч / г углерода, а катоды, катализируемые кобальтом, работали на втором месте с удельной емкостью 2414 мА · ч / г углерода. Основываясь на первом моделировании литий-воздушных батарей в масштабе пор, микроструктура катода значительно влияет на емкость батареи как в режимах без блокировки пор, так и в режимах блокировки пор.
Большинство ограничений для литий-воздушных батарей находятся у катода, что также является источником его потенциальных преимуществ. На катоде должен присутствовать атмосферный кислород, но такие загрязнения, как водяной пар, могут его повредить. Неполный разряд из-за засорения пористого углеродного катода продуктами разряда, такими как пероксид лития (в апротонных конструкциях), является наиболее серьезным.
Катализаторы показали себя многообещающими в создании преимущественного зародышеобразования Li. 2O. 2по сравнению с Li. 2O, которое необратимо по отношению к литию.
Характеристики Li-воздух ограничены эффективностью реакция на катоде, потому что большая часть падения напряжения происходит именно там. Были оценены различные химические составы, различающиеся по электролиту. Это обсуждение фокусируется на апротонных и водных электролитах, поскольку твердотельная электрохимия плохо изучена.
В ячейке с апротонным электролитом оксиды лития получают восстановлением на катоде:
, где «*» обозначает участок поверхности Li. 2O. 2, где происходит рост, который по существу является нейтральной вакансией Li на поверхности Li. 2O. 2.
Оксиды лития нерастворимы в апротонных электролитах, что приводит к засорению катода.
Катод с массивом нанопроволок MnO. 2, усиленный генетически модифицированным вирусом бактериофага M13, предлагает два до трехкратной плотности энергии литий-ионных аккумуляторов 2015 года выпуска. Вирус увеличил размер массива нанопроволок, который составляет около 80 нм в поперечнике. Полученные провода имели шипованную поверхность. Шипы создают большую площадь поверхности для размещения участков реакции. Вирусный процесс создает сшитую трехмерную структуру, а не изолированные проволочки, стабилизирующие электрод. Вирусный процесс основан на воде и протекает при комнатной температуре.
Усилия по созданию литий-воздушных аккумуляторов были сосредоточены на четырех электролитах: водный кислотный, водный щелочной, неводный протонный и и апротический.
В ячейке с водным электролитом при восстановлении на катоде также может образоваться гидроксид лития:
водный Литий-воздушная батарея состоит из металлического литиевого анода, водного электролита и пористого углеродного катода. Водный электролит объединяет соли лития, растворенные в воде. Это позволяет избежать засорения катода, поскольку продукты реакции водорастворимы. Водный дизайн имеет более высокий практический разрядный потенциал, чем его апротонный аналог. Однако металлический литий бурно реагирует с водой, и поэтому конструкция на водной основе требует твердой поверхности раздела электролита между литием и электролитом. Обычно используется литий-проводящая керамика или стекло, но проводимость обычно низкая (порядка 10 См / см при температуре окружающей среды).
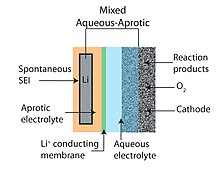 Схема конструкции литий-воздушной батареи смешанного водно-апротонного типа
Схема конструкции литий-воздушной батареи смешанного водно-апротонного типа Конъюгат основания участвует в реакции. Теоретическая максимальная удельная энергия и плотность энергии литий-воздушной ячейки составляют 1400 Вт · ч / кг и 1680 Вт · ч / л, соответственно.
Молекулы воды участвуют в окислительно-восстановительных реакциях на воздушном катоде. Теоретическая максимальная удельная энергия и плотность энергии литий-воздушной ячейки составляют 1300 Вт · ч / кг и 1520 Вт · ч / л, соответственно.
Новые катодные материалы должны учитывать размещение значительных количеств LiO. 2, Li. 2O. 2и / или LiOH, не вызывая блокирования катодных пор, и используют подходящие катализаторы, чтобы сделать электрохимические реакции энергетически практичными.
 Схема конструкции литий-воздушной батареи апротонного типа
Схема конструкции литий-воздушной батареи апротонного типа Сначала были продемонстрированы неводные литий-воздушные батареи. Они обычно используют смешанные этиленкарбонат + пропиленкарбонат растворители с LiPF 6 или литий-бис-сульфонимидными солями, как и обычные литий-ионные батареи, однако с гелеобразным, а не гелеобразным жидкий электролит. Разница напряжений при зарядке и разрядке постоянным током обычно составляет от 1,3 до 1,8 В (с OCP около 4,2 В) даже при таких смехотворно малых токах, как 0,01–0,5 мА / см² и 50–500 мА / г C на положительный электрод (см. рисунок 2). Однако карбонатные растворители испаряются и окисляются из-за высокого перенапряжения при зарядке. Рассматривались другие растворители, такие как глимы с концевыми группами, ДМСО, диметилацетамид и ионные жидкости. Углеродный катод окисляется выше +3,5 В v Li во время заряда, образуя Li 2CO3, что приводит к необратимой потере емкости.
Наибольшие усилия были приложены апротонными материалами, которые состоят из анод из металлического лития, жидкий органический электролит и пористый углеродный катод. Электролит может состоять из любой органической жидкости, способной сольватировать соли лития, такой как LiPF. 6, LiAsF. 6, LiN (SO. 2CF. 3). 2и LiSO. 3CF. 3), но обычно состоит из карбонатов, простые эфиры и сложные эфиры. Углеродный катод обычно изготавливается из углеродного материала с большой площадью поверхности с наноструктурированным металлооксидным катализатором (обычно MnO. 2или Mn. 3O. 4). Основным преимуществом является самопроизвольное образование барьера между анодом и электролитом (аналогично барьеру, образованному между электролитом и углеродно-литиевыми анодами в обычных литий-ионных батареях), который защищает металлический литий от дальнейшей реакции с электролитом. Хотя Li. 2O. 2, образующийся на катоде, является перезаряжаемым, он обычно нерастворим в органическом электролите, что приводит к накоплению на границе раздела катод / электролит. Это делает катоды в апротонных батареях склонными к засорению и увеличению объема, что постепенно снижает проводимость и ухудшает характеристики батареи. Другая проблема заключается в том, что органические электролиты воспламеняются и могут воспламениться при повреждении элемента.
Хотя большинство исследований сходятся во мнении, что Li. 2O. 2является конечным продуктом разряда неводного Li-O 2 батареи, убедительное доказательство того, что его образование протекает не как прямое 2-электронное электровосстановление до пероксида O. 2(что является обычным путем для восстановления O 2 в воде на углероде), а скорее через –Электронное восстановление до супероксида O. 2с последующим его диспропорционированием:
| 2LiO. 2⇌ Li. 2O. 2+O. 2 | (1) |
Супероксид (O. 2) традиционно считается опасным промежуточным продуктом в апротонных кислородных батареях из-за его высокой нуклеофильности, основности и окислительно-восстановительного потенциала. Однако отчеты предполагают, что LiO 2 одновременно является промежуточным звеном во время разряда в пероксид (Li. 2O. 2) и может использоваться в качестве конечный продукт разряда, потенциально с увеличенным сроком службы, хотя и с более низкой удельной энергией (немного более тяжелый вес батареи). Действительно, было показано, что при определенных условиях супероксид может быть стабильным в течение 20–70 ч при комнатной температуре. Необратимая потеря емкости из-за диспропорционирования LiO 2 в заряженной батарее не рассматривалась.
Pt / C, по-видимому, является лучшим электрокатализатором для выделения O 2 и Au / C для восстановления O 2, когда Li. 2O. 2является продуктом. Тем не менее, «производительность перезаряжаемых литий-воздушных батарей с неводными электролитами ограничена реакциями на кислородном электроде, особенно выделением O 2. Обычные пористые углеродно-воздушные электроды не могут обеспечить мАч / г емкость и скорость разряда мАч / см, необходимые для аккумуляторов с действительно высокой плотностью энергии для электромобилей ». Емкость (в мАч / см) и срок службы неводных Li-O 2 батарей ограничиваются отложением нерастворимых и плохо проводящих электроны фаз LiOx при разряде. (Предполагается, что Li. 3O. 4будет иметь лучшую проводимость Li +, чем фазы LiO 2 и Li. 2O. 2). Это делает практическую удельную энергию Li-O 2 батарей значительно меньше, чем предсказывает расчет уровня реагента. Похоже, что эти параметры достигли своего предела, и дальнейшее улучшение ожидается только от альтернативных методов.
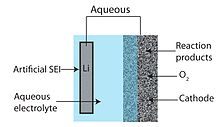 Схема конструкции литий-воздушной батареи водного типа
Схема конструкции литий-воздушной батареи водного типа Конструкция водно-апротонной или смешанной литиево-воздушной батареи пытается объединить преимущества апротонной и водной конструкций батарей. Общей чертой гибридных конструкций является двухкомпонентный (одна часть водного и одна апротонная) электролит, соединенный литий-проводящей мембраной. Анод упирается в апротонную сторону, в то время как катод контактирует с водной стороной. Литий-проводящая керамика обычно используется в качестве мембраны, соединяющей два электролита.
Использование твердого электролита (см. Рис. 3) является одним из таких альтернативных подходов, которые позволяют комбинировать анод из металлического лития с водный катод. Керамические твердые электролиты (CSE) семейства NASICON (например, Li 1-x AxM2-x (PO 4)3с A ∈ [Al, Sc, Y] и M ∈ [Ti, Ge]). Совместимы с водой при щелочном pH и имеют большое электрохимическое окно (см. Рис. 3,4), их низкая проводимость по ионам Li + при комнатной температуре (< 0.005 S/cm,>85 Ом · см) делает их непригодными для использования в автомобилях и стационарные накопители энергии, требующие невысокой стоимости (т. е. рабочие плотности тока более 100 мА / см). Кроме того, и Ti, и Ge восстанавливаются за счет металлического Li, и требуется промежуточный слой между керамическим электродом и отрицательным электродом. твердые полимерные электролиты (ТПЭ) могут обеспечивать более высокую проводимость за счет более быстрого перехода воды и других небольших молекул, которые реактивны по отношению к металлическому Li. Среди более экзотических мембран, рассматриваемых для Li-O 2 аккумуляторы - это монокристаллический кремний.
В 2015 году исследователи объявили о конструкции, в которой для измерения заряда использовался высокопористый графен. анод, электролит бис (трифторметил) сульфонилимида лития / диметоксиэтана с добавлением воды и иодида лития для использования в качестве «посредника». Электролит производит гидроксид лития (LiOH) на катоде вместо пероксида лития (Li. 2O. 2). Результат обеспечил энергоэффективность 93% (разрыв напряжения 0,2) и более 2000 циклов включения без малейшего влияния на производительность. Однако конструкция требовала чистого кислорода, а не окружающего воздуха.
 Схема конструкции твердотельной литий-воздушной батареи
Схема конструкции твердотельной литий-воздушной батареи A конструкция твердотельной батареи привлекательна своей безопасностью, устраняя шанс возгорания от разрыва. В современных твердотельных литий-воздушных батареях используются литиевый анод, керамический, стеклянный или стеклокерамический электролит и пористый углеродный катод. Анод и катод обычно отделены от электролита полимерно-керамическими композитами, которые усиливают перенос заряда на аноде и электрохимически связывают катод с электролитом. Полимерно-керамические композиты уменьшают полное сопротивление. Основным недостатком твердотельной батареи является низкая проводимость большинства стеклокерамических электролитов. Ионная проводимость литиевых проводников с быстрыми ионами ниже, чем у альтернативных жидких электролитов.
По состоянию на 2013 год конструкторы столкнулись с множеством проблем.
Большинство ограничений для литий-воздушной батареи находится на катоде, что также является источником ее потенциальных преимуществ. Неполный разряд из-за засорения пористого углеродного катода продуктами разряда, такими как пероксид лития (в апротонных конструкциях), является наиболее серьезным. Было смоделировано несколько режимов выделения. Параметр Da был определен для измерения изменений температуры, концентрации частиц и потенциалов.
Влияние размера пор и распределения пор по размерам остается плохо изученным.
Катализаторы показали многообещающие при создании Предпочтительное зародышеобразование Li. 2O. 2по сравнению с Li. 2O, которое является необратимым по отношению к литию.
На катоде должен присутствовать атмосферный кислород, но загрязняющие вещества, такие как водяной пар, могут его повредить.
В конструкциях элементов 2017 года перенапряжение заряда намного выше, чем перенапряжение разряда. Значительное перенапряжение заряда указывает на наличие вторичных реакций. Таким образом, электрический КПД составляет всего около 65%.
Катализаторы, такие как MnO. 2, Co, Pt и Au, потенциально могут снизить перенапряжения, но эффект плохо изучен. Несколько катализаторов улучшают характеристики катода, особенно MnO. 2, и механизм улучшения известен как поверхностный окислительно-восстановительный потенциал кислорода, обеспечивающий обильные начальные центры роста пероксида лития. Сообщается также, что катализаторы могут изменять структуру оксидных отложений.
Еще одной проблемой является значительное падение емкости элемента с увеличением скорости разряда. Уменьшение емкости ячейки связано с ограничениями кинетической передачи заряда. Поскольку анодная реакция происходит очень быстро, считается, что пределы переноса заряда возникают на катоде.
Длительная работа от аккумулятора требует химической стабильности всех компонентов элемента. Современные конструкции ячеек демонстрируют плохую устойчивость к окислению продуктами реакции и промежуточными продуктами. Многие водные электролиты летучие и со временем могут испаряться. Стабильности в целом препятствуют паразитарные химические реакции, например реакции с участием реактивного кислорода.
Литий-воздушные элементы представляют интерес для электромобилей, поскольку они высокая теоретическая удельная и объемная плотность энергии, сравнимая с бензином. Электродвигатели обеспечивают высокий КПД (95% по сравнению с 35% для двигателя внутреннего сгорания ). Литий-воздушные элементы могут обеспечить дальность действия, эквивалентную сегодняшним автомобилям с аккумуляторной батареей, размер которой составляет одну треть стандартного топливного бака, при условии, что остальная часть оборудования, необходимая для обслуживания батареи, имеет незначительную массу или объем.
В 2014 году исследователи анонсировали гибридную солнечную батарею. До 20% энергии, производимой обычными солнечными элементами, теряется, когда она направляется в аккумулятор и заряжает его. Гибрид накапливает почти 100% произведенной энергии. В одной из версий гибрида использовалась ионно-калиевая батарея, работающая на калий-воздухе. Он обладал более высокой плотностью энергии, чем обычные литий-ионные батареи, стоил меньше и позволял избежать токсичных побочных продуктов. Последнее устройство по существу заменило калий литием.
В солнечном элементе использовалась сетка, сделанная из микроскопических стержней из диоксида титана, чтобы пропустить необходимый кислород. Захваченный солнечный свет производил электроны, которые разлагали пероксид лития на ионы лития, тем самым заряжая аккумулятор. Во время разряда кислород из воздуха пополнял перекись лития.