Хиральные кислоты Льюиса (CLA) представляют собой тип кислоты Льюиса катализатора, что влияет на хиральность субстрата, когда он реагирует с ним. В таких реакциях синтез способствует образованию определенного энантиомера или диастереомера. Таким образом, метод представляет собой реакцию энантиоселективного асимметричного синтеза. Поскольку они влияют на хиральность, они производят оптически активные продукты из оптически неактивных или смешанных исходных материалов. Этот тип преимущественного образования одного энантиомера или диастереомера по сравнению с другим формально известен как асимметричная индукция. В этой разновидности кислоты Льюиса. электроноакцепторный атом обычно представляет собой металл, такой как индий, цинк, литий, алюминий, титан или бор. Хиральные -изменяющие лиганды, используемые для синтеза этих кислот, чаще всего имеют несколько основных льюисовских сайтов (часто диол или структуру диазота), которые позволяют образовывать кольцевая структура с участием атома металла.
Ахиральные кислоты Льюиса использовались в течение десятилетий для ускорения синтеза рацемических смесей в бесчисленных различных реакциях. С 1960-х годов химики использовали хиральные кислоты Льюиса для индукции энантиоселективных реакций. Это полезно, когда желаемый продукт представляет собой конкретный энантиомер, обычно используемый в синтезе лекарств. Обычные типы реакций включают реакции Дильса-Альдера, еновую реакцию, реакции [2 + 2] циклоприсоединения, гидроцианирование альдегидов и в первую очередь эпоксидирования Шарплесса.
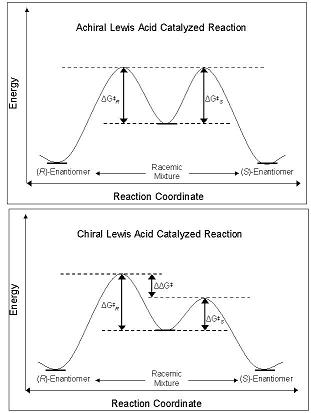 Рисунок 2. Вверху: диаграмма свободной энергии Гиббса изображающая одностадийную реакцию, в которой ахиральная кислота Льюиса катализирует образование рацемической смеси продуктов из рацемических исходных материалов. Внизу: диаграмма свободной энергии Гиббса, изображающая ту же реакцию при использовании хиральной кислоты Льюиса в качестве катализатора
Рисунок 2. Вверху: диаграмма свободной энергии Гиббса изображающая одностадийную реакцию, в которой ахиральная кислота Льюиса катализирует образование рацемической смеси продуктов из рацемических исходных материалов. Внизу: диаграмма свободной энергии Гиббса, изображающая ту же реакцию при использовании хиральной кислоты Льюиса в качестве катализатора Энантиоселективность CLA проистекает из их способности нарушать свободный энергетический барьер вдоль координаты реакции путь, ведущий к R- или S-энантиомеру. Диастереомеры и энантиомеры в основном состоянии имеют одинаковую энергию в основном состоянии, и при взаимодействии с ахиральной кислотой Льюиса их диастереомерные промежуточные соединения, переходные состояния и продукты также имеют одинаковую энергию. Это приводит к получению рацемических смесей продуктов. Однако, когда CLA используется в той же реакции, энергетический барьер образования одного диастереомера меньше, чем у другого - реакция находится под кинетическим контролем. Если разница в энергетических барьерах между диастереомерными переходными состояниями достаточно велика, то должен наблюдаться высокий энантиомерный избыток одного изомера (рисунок 2).
Реакции Дильса-Альдера происходят между конъюгированным диеном и алкеном (широко известным как диенофил ). Этот процесс циклоприсоединения делает возможным стереоселективное образование циклогексеновых колец, способных иметь до четырех смежных стереогенных центров.
Реакции Дильса-Альдера могут приводить к образованию множества структурных изомеров и стереоизомеров. теория молекулярных орбиталей считает, что эндо-переходное состояние, а не экзо-переходное состояние, является предпочтительным (правило эндо-сложения ). Кроме того, усиленные вторичные орбитальные взаимодействия были постулированы как источник усиленного эндо-диастереоселекции.

Добавление CLA селективно активирует один компонент реакции (диен или диенофил), обеспечивая при этом стереотипное окружение, которое обеспечивает уникальную энантиоселективность.
Кога и его коллеги раскрыли первый практический пример каталитической энантиоселективной реакции Дильса-Альдера, инициируемой CLA - дихлоридом ментоксиалюминия - производным ментола и этилалюминий дихлорида.

Десять лет спустя, Элиас Джеймс Кори представил эффективный регулятор алюминия-диамина для реакции Дильса-Альдера. Образование активного катализатора достигается обработкой бис (сульфонамида) триметилалюминием; восстановление лиганда было по существу количественным. Предлагаемый четырехкоординатный алюминий предотвращает действие имида в качестве хелатирующего основания Льюиса, в то же время усиливая α-винильный протон диенофила и бензильный протон катализатора.

Рентгеновская структура катализатора показала стереотипное окружение.

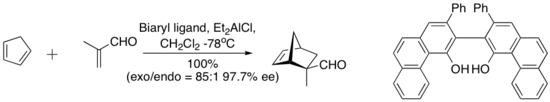
В 1993 году Вульф и его сотрудники обнаружили комплекс, полученный из хлорида диэтилалюминия и «сводчатого» биарила. лиганд, указанный ниже, катализирует энантиоселективную реакцию Дильса-Альдера между циклопентадиеном и метакролеином. Хиральный лиганд количественно выделяют с помощью хроматографии на силикагеле .
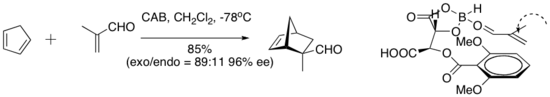
Hisashi Yamamoto, и его сотрудники разработали практичный катализатор Дильса-Альдера для альдегиддиенофилов. Хиральный (ацилокси) борановый (CAB) комплекс эффективен в катализе ряда альдегидных реакций Дильса-Альдера. Эксперименты по ЯМР-спектроскопии показали близость альдегида и арильного кольца. Кроме того, наложение Pi между арильной группой и альдегидом было предложено в качестве организационной особенности, которая придает высокую энантиоселективность циклоприсоединения.
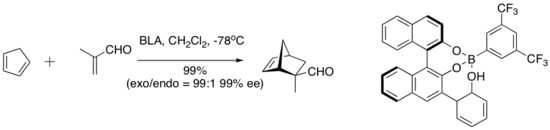
Ямамото и его сотрудники представили концептуально интересную серию катализаторов, которые включают кислотный протон в активный катализатор. Этот вид так называемой хиральной кислоты Льюиса с кислотой Бренстеда (BLA) катализирует ряд реакций диен-альдегидного циклоприсоединения.
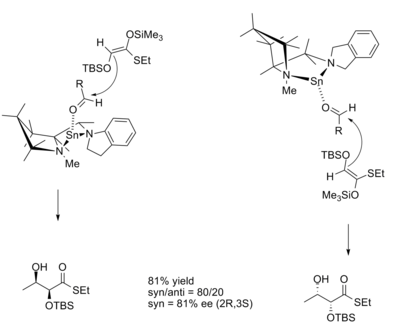
В реакции альдола диастереоселективность Размер продукта часто диктуется геометрией енолата в соответствии с моделью Циммермана-Тракслера. Модель предсказывает, что енолят Z будут давать продукты syn, а еноляты E будут давать продукты анти. Хиральные кислоты Льюиса позволяют получать продукты, которые противоречат модели Циммермана-Тракслера, и позволяют контролировать абсолютную стереохимию. Кобаяши и Хорибе продемонстрировали это при синтезе производных дигидрокситиоэфиров с использованием хиральной кислоты Льюиса на основе олова.

Переходные структуры для реакций с катализатором R и S энантиомерами показаны ниже.
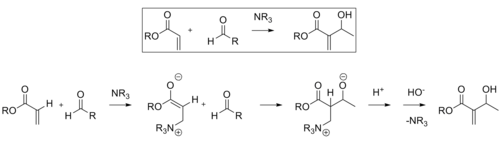
Реакция Бейлиса-Хиллмана представляет собой путь образования CC-связи между альфа, бета-ненасыщенным карбонилом и альдегидом, для которого требуется нуклеофильный катализатор, обычно третичный амин, для присоединения и удаления типа Михаэля. Стереоселективность этих реакций обычно невысока. Chen et al. продемонстрировали энантиоселективную реакцию, катализируемую хиральной кислотой Льюиса. В данном случае использовался лантан. Подобным образом для достижения стереоселективности можно также использовать хиральный амин.
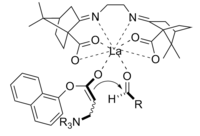
Продукт, полученный реакцией с использованием хирального катализатора, был получен с хорошим выходом и превосходной энантиоселективностью.
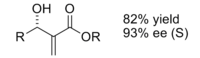
Хиральные кислоты Льюиса также оказались полезными в еновой реакции. При катализе ахиральной кислотой Льюиса реакция обычно обеспечивает хорошую диастереоселективность.
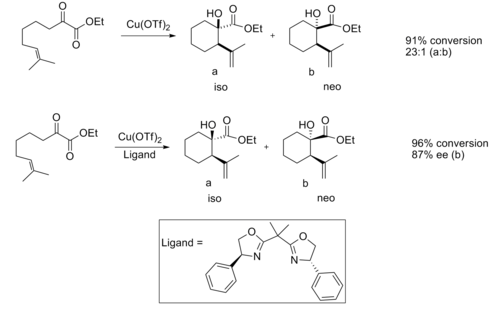
При использовании катализатора на основе хиральной кислоты Льюиса наблюдается хорошая энантиоселективность.

Считается, что энантиоселективность обусловлена стерическими взаимодействиями между метил и фенильной группой, что значительно увеличивает переходную структуру изопродукта. благоприятный.
Катализируемое никелем сочетание 1,3-диенов с альдегидами. В некоторых случаях ахиральная кислота Льюиса может обеспечивать хорошую стереоселективность. Kimura et al. продемонстрировали регио- и диастереоселективное сочетание 1,3- диенов с альдегидами.
Асимметричный синтез и получение энантиомерно чистых веществ с использованием CLA представляет особый интерес для химиков-органиков и фармацевтических корпораций. Поскольку многие фармацевтические препараты нацелены на ферменты, специфичные для конкретного энантиомера, соединения, предназначенные для введения пациенту, должны иметь высокую оптическую чистоту. Кроме того, выделение конкретного энантиомера из рацемической смеси является как дорогостоящим, так и расточительным.