В химии гидроцианирование - это процесс превращения алкенов в нитрилы. Реакция включает добавление цианистого водорода и требует катализатора. Это преобразование проводится в промышленных масштабах для производства прекурсоров нейлона.
Промышленно, гидроцианирования обычно проводится на алкенах, катализируемых никелевые комплексами из фосфита (P (OR) 3) лигандов. Проявляется общая реакция:
Реакция включает добавление H + и - CN к субстрату. Обычно субстрат представляет собой алкен, а продукт - нитрил.
Реакция протекает через окислительное присоединение HCN к комплексу низковалентного металла с образованием гидридоцианидного комплекса. Последующее связывание алкена дает промежуточное соединение M (H) (CN) L n (алкен), которое затем претерпевает мигрирующую вставку с образованием цианида алкилметалла. Цикл завершается восстановительным удалением нитрила.
Кислоты Льюиса, такие как B (C 6 H 5) 3, вызывают восстановительное отщепление нитрильного продукта, увеличивая скорость.
В случае систем на основе никеля дезактивация катализатора включает образование разновидностей дицианоникеля (II), которые не вступают в реакцию по отношению к алкенам. Дицианид возникает двумя путями (L = фосфит):
Большинство алкенов являются прохиральными, что в данном контексте означает, что при их гидроцианировании образуются хиральные нитрилы. Обычные катализаторы гидроцианирования, например Ni (P (OR) 3) 4, катализируют образование рацемических смесей. Однако, когда опорные лиганды являются хиральными, гидроцианирование может быть весьма энантиоселективным. Для асимметрического гидроцианирования, популярные хиральные лиганды хелатирующих арильного дифосфита комплексы.
Наиболее важным промышленным применением является катализируемый никелем синтез адипонитрила (NC– (CH 2) 4 –CN) синтез из бута-1,3-диена (CH 2 = CH – CH = CH 2). Адипонитрил является предшественником к гексаметилендиамину (Н 2 N- (CH 2) 6 -NH 2), который используется для производства определенных видов нейлона. Дюпон процесс ADN, чтобы дать адипонитрил показано ниже:

Этот процесс состоит из трех стадий: гидроцианирование бутадиена до смеси 2-метилбутен-3-нитрила (2M3BM) и пентен-3-нитрила (3PN), стадия изомеризации от 2M3BM (нежелательно) до 3PN и вторая гидроцианирование (при содействии сокатализатора кислоты Льюиса, такого как трихлорид алюминия или трифенилбор) до адипонитрила.
Гидроцианирование важно из-за универсальности алкилнитрилов (RCN), которые являются важными промежуточными продуктами для синтеза амидов, аминов, карбоновых кислот и сложных эфиров.
Напроксен, противовоспалительное лекарственное средство, получают с помощью асимметрического гидроцианирования в винилнафталин, использующей phosphinite (OPR 2) лиганд, L. Энантиоселективность этой реакции важна, потому что только S- энантиомер является желательным с медицинской точки зрения, тогда как R-энантиомер оказывает вредное воздействие на здоровье. Эта реакция может дать S-энантиомер со стереоселективностью gt; 90%. После перекристаллизации сырого продукта можно получить оптически чистый нитрил.
Впервые о гидроцианировании сообщили Артур и Пратт в 1954 году, когда они гомогенно катализировали гидроцианирование линейных алкенов. Промышленный процесс каталитического гидроцианирования бутадиена в адипонитрил был изобретен Уильямом К. Дринкардом.
При трансгидроцианировании эквивалент HCN переносится от циангидрина, например, ацетонциангидрина, к другому акцептору HCN. Перенос - это равновесный процесс, инициированный базой. Реакция может быть вызвана реакциями улавливания или использованием лучшего акцептора HCN, такого как альдегид.
α, β-ненасыщенные карбонильные соединения подвергаются гидроцианированию в отсутствие металлических катализаторов. Одним из проявлений является особый случай реакции Михаэля, приводящей к β-цианокетонам. Другое проявление приводит к винилциангидринам. Также наблюдаются β-циано-циангидрины. Условия реакции позволяют получить доступ к любому из этих продуктов.
(1)
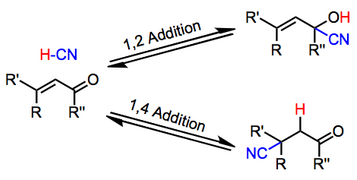
Обычно кислотные условия благоприятствуют 1,2-аддуктам, тогда как основные условия благоприятствуют 1,4-аддуктам. Добавки цианидов щелочных металлов, например, приводят исключительно к 1,4-присоединению. В отличие от цианидов и цианоалюминатов щелочных металлов, кислые цианиды Льюиса, такие как TMSCN, способствуют 1,2-присоединению. Ацетиленовые субстраты подвергаются реакции; однако объем этой реакции ограничен, и выходы часто низкие.
(5)

1,4-Присоединение к иминам наблюдалось в нескольких случаях, хотя имины часто являются базально лабильными.
(6)

Сложные эфиры, нитрилы и другие карбонильные производные также подвергаются сопряженному гидроцианированию.
При использовании цианидов щелочных металлов обычно необходима по крайней мере частичная нейтрализация реакционной среды. Нейтрализация может осуществляться через кислотную группу в самом подсостоянии (внутренняя нейтрализация). или путем добавления кислоты извне (внешняя нейтрализация). Для этой цели обычно используется уксусная кислота в процедуре, впервые предложенной Лэпвортом.
(7)

Конъюгативное гидроцианирование использовали для получения стероидного D-кольца. В этих реакциях присоединения диастереоселективность обычно высока, и полученные β-цианокарбонильные соединения могут быть превращены в ряд стероидных продуктов.