| Пропионил-КоА карбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 6.4.1.3 | ||||||||
| Номер CAS | 9023-94-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Представление IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Представление NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология гена | AmiGO / QuickGO | ||||||||
| |||||||||
| Метилмалонил-КоА декарбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер EC | 4.1.1.41 | ||||||||
| Номер CAS | 37289-44-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Представление NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
пропионил-CoA карбоксилаза (PCC ) катализирует реакцию карбоксилирования пропионил-CoA в митохондриальный матрикс. Фермент биотин -зависимый. Продукт реакции представляет собой (S) - метилмалонил-КоА. Пропионил-КоА является конечным продуктом метаболизма жирных кислот с нечетной цепью, а также является метаболитом большинства метил-разветвленных жирных кислот. Он также является основным метаболитом валина и вместе с ацетил-КоА является метаболитом изолейцина, а также метаболитом метионина. Пропионил-КоА, таким образом, имеет большое значение как предшественник глюкозы. (S) -Метилмалонил-КоА не используется животными напрямую; на него действует рацемаза, давая (R) -метилмалонил-КоА. Последний превращается с помощью мутазы метилмалонил-КоА (один из очень немногих витамин В 12 -зависимых ферментов) с образованием сукцинил-КоА. Последний превращается в оксалоацетат, а затем в малат в цикле Кребса. Экспорт малата в цитозоль приводит к образованию оксалоацетата, пирувата фосфоенола и других глюконеогенных промежуточных продуктов.
Он был классифицирован как лигаза и лиаза.
Пропионил-CoA-карбоксилаза (PCC) представляет собой альфа (6) -бета 750 кДа (6) -dodecamer. (Только приблизительно 540 кДа является нативным ферментом.) Альфа-субъединицы расположены как мономеры, украшающие центральное бета-6 гексамерное ядро. Этот сердечник ориентирован в виде короткого цилиндра с отверстием вдоль его оси.
Альфа-субъединица PCC содержит домены биотинкарбоксилазы (BC) и биотин карбоксильный белок-носитель (BCCP). Домен, известный как домен BT, также расположен на альфа-субъединице и необходим для взаимодействия с бета-субъединицей. 8-мицепочечная антипараллельная бета-бочка складка этого домена особенно интересна. Бета-субъединица содержит активность карбоксилтрансферазы (СТ).
 Рисунок 1. (а). Схематическое изображение структуры химеры RpPCCα-RdPCCβ, если смотреть вниз по оси симметрии третьего порядка. Домены в субъединицах α и β в верхней половине структуры обозначены разными цветами, а домены в первых субъединицах α и β помечены. Субъединицы α и β в нижней половине окрашены в пурпурный и зеленый цвета соответственно. Красная стрелка указывает направление обзора панели b. (б). Структура химеры RpPCCα-RdPCCβ, если смотреть вниз по двойной оси симметрии. Красный прямоугольник указывает на область, подробно показанную на рис. 2а. (с). Крио-ЭМ реконструкция HsPCC с разрешением 15 Å, если смотреть в той же ориентации, что и панель а. Атомная модель химеры помещалась в крио-ЭМ конверт. (г). Крио-ЭМ реконструкция в той же ориентации, что и панель b. Стрелки указывают на изменение положения BCCP, которое необходимо для соответствия крио-ЭМ карте. Все структурные фигуры были получены с помощью PyMOL (www.pymol.org), а крио-ЭМ-фигуры были получены с помощью Chimera. Это является четким доказательством решающего димерного взаимодействия между альфа- и бета-субъединицами.
Рисунок 1. (а). Схематическое изображение структуры химеры RpPCCα-RdPCCβ, если смотреть вниз по оси симметрии третьего порядка. Домены в субъединицах α и β в верхней половине структуры обозначены разными цветами, а домены в первых субъединицах α и β помечены. Субъединицы α и β в нижней половине окрашены в пурпурный и зеленый цвета соответственно. Красная стрелка указывает направление обзора панели b. (б). Структура химеры RpPCCα-RdPCCβ, если смотреть вниз по двойной оси симметрии. Красный прямоугольник указывает на область, подробно показанную на рис. 2а. (с). Крио-ЭМ реконструкция HsPCC с разрешением 15 Å, если смотреть в той же ориентации, что и панель а. Атомная модель химеры помещалась в крио-ЭМ конверт. (г). Крио-ЭМ реконструкция в той же ориентации, что и панель b. Стрелки указывают на изменение положения BCCP, которое необходимо для соответствия крио-ЭМ карте. Все структурные фигуры были получены с помощью PyMOL (www.pymol.org), а крио-ЭМ-фигуры были получены с помощью Chimera. Это является четким доказательством решающего димерного взаимодействия между альфа- и бета-субъединицами. Сайты BC и CT разнесены примерно на 55 Å, что свидетельствует о перемещении всего домена BCCP во время катализа карбоксилирования элемента пропионил-КоА. Это обеспечивает четкое свидетельство решающего димерного взаимодействия между альфа- и бета-субъединицами.
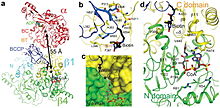 Рисунок 2. (а). Схематическое изображение относительного расположения активных центров BC и CT в холоферменте. Показаны одна субъединица α и димер β2 (β1 из одного слоя и β4 из другого слоя), а направление обзора такое же, как на рис. 1b. Два активных центра обозначены звездами, разделенными расстоянием 55 Å. Также показаны связанные положения ADP в комплексе с E. coli BC 18 и CoA в комплексе с 12S субъединицей транскарбоксилазы 21. (б). Подробные взаимодействия между BCCP-биотином и С-доменом субъединицы β. Взаимодействия с водородными связями обозначены пунктирными линиями красного цвета. Атом N1 'биотина обозначен как 1', он связан водородной связью с карбонилом основной цепи Phe397. (с). Молекулярная поверхность активного сайта CT, показывающая глубокий каньон, где связаны оба субстрата. (г). Схематическое изображение активного сайта СТ.
Рисунок 2. (а). Схематическое изображение относительного расположения активных центров BC и CT в холоферменте. Показаны одна субъединица α и димер β2 (β1 из одного слоя и β4 из другого слоя), а направление обзора такое же, как на рис. 1b. Два активных центра обозначены звездами, разделенными расстоянием 55 Å. Также показаны связанные положения ADP в комплексе с E. coli BC 18 и CoA в комплексе с 12S субъединицей транскарбоксилазы 21. (б). Подробные взаимодействия между BCCP-биотином и С-доменом субъединицы β. Взаимодействия с водородными связями обозначены пунктирными линиями красного цвета. Атом N1 'биотина обозначен как 1', он связан водородной связью с карбонилом основной цепи Phe397. (с). Молекулярная поверхность активного сайта CT, показывающая глубокий каньон, где связаны оба субстрата. (г). Схематическое изображение активного сайта СТ. Биотин-связывающий карман PCC является гидрофобным и высококонсервативным. Биотин и пропионил-КоА связываются перпендикулярно друг другу в активном сайте, содержащем оксианионную дырку. Отношение нативного фермента к биотину составляет один моль нативного фермента на 4 моль биотина. Считается, что N1 биотина является основанием активного сайта.
Сайт-направленный мутагенез в D422 показывает изменение субстратной специфичности сайта связывания пропионил-КоА, что указывает на важность этого остатка в каталитической активности PCC. В 1979 году ингибирование с помощью фенилглиоксаля показало, что фосфатная группа из пропионил-КоА или АТФ реагирует с существенным остатком аргинина в активном центре во время катализа. Позже (2004 г.) было высказано предположение, что аргинин-338 служит для ориентации карбоксифосфатного промежуточного соединения для оптимального карбоксилирования биотина.
Значения KM для АТФ, пропионил-КоА и бикарбоната были определено как 0,08 мМ, 0,29 мМ и 3,0 мМ соответственно. Изоэлектрическая точка соответствует pH 5,5. Структурная целостность PCC сохраняется в диапазоне температур от -50 до 37 градусов Цельсия и диапазоне pH от 6,2 до 8,8. Было показано, что оптимальный pH составляет от 7,2 до 8,8 без связывания биотина. Оптимальное значение pH для биотина составляет 8,0-8,5.
Нормальный механизм каталитической реакции включает промежуточное соединение карбанион и не проходит согласованный процесс. На рисунке 3 показан вероятный путь.
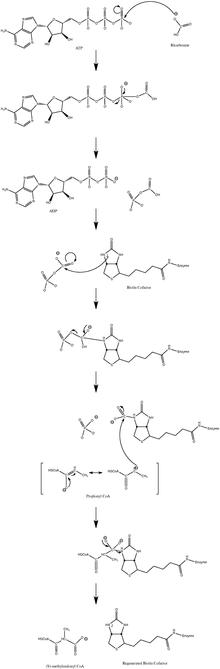 Рис. 3. Вероятный механизм PCC
Рис. 3. Вероятный механизм PCC Было показано, что реакция слегка обратима при низком потоке пропионил-КоА.
Люди экспрессируют следующие две пропионил-КоА карбоксилазы изоферменты :
|
| ||||||||||||||||||||||||||||||||||||||||||||
Дефицит связан с пропионовой ацидемией.
Активность PCC является наиболее чувствительным индикатором статуса биотина, испытанным на сегодняшний день. В будущих исследованиях беременности использование данных об активности PCC лимфоцитов должно оказаться полезным при оценке статуса биотина.
Когда несколько копий полипептида, кодируемого геном образуют агрегат, эта структура белка упоминается как мультимер. Когда мультимер формируется из полипептидов, продуцируемых двумя разными мутантными аллелями конкретного гена, смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. В таком случае явление упоминается как внутригенная комплементация..
PCC представляет собой гетерополимер, состоящий из субъединиц α и β в структуре α 6β6. Мутации в PCC, либо в субъединице α (PCCα), либо в субъединице β (PCCβ), могут вызывать пропионовую ацидемию у людей. Когда разные мутантные линии клеток кожи фибробластов, дефектные по PCCβ, были слиты в попарных комбинациях, образующийся в результате β гетеромультимерный белок часто проявлял более высокий уровень активности, чем можно было бы ожидать, исходя из активность родительских ферментов. Это открытие внутригенной комплементации показало, что мультимерная структура PCC допускает кооперативные взаимодействия между составляющими мономерами PCCβ, которые могут генерировать более функциональную форму холофермента.
a. Карбамазепин (противоэпилептическое средство): значительно снижает уровень ферментов в печени
b. E. coli шаперонин, белки groES и groEL: необходимы для укладки и сборки гетеромерных субъединиц PCC человека
c. Бикарбонат: отрицательная кооперативность
d. Mg и MgATP: аллостерическая активация
a. 6-дезоксиэритронолид B: снижение уровней PCC приводит к увеличению производства
b. Глюкокиназа в бета-клетках поджелудочной железы: предшественник бета-PCC, как показано, снижает KM и увеличивает Vmax; активация