| FOLH1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | FOLH1, FGCP, FOLH, GCP2, GCPII, NAALAD1, NAALAdase, PSM, PSMA, mGCP, фолатгидролаза (простатоспецифический мембранный антиген) 1, фолатгидролаза 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 600934 HomoloGene : 136782 GeneCards : FOLH1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Виды | Человек | Мышь | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entrez |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ensembl |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UniProt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RefSeq (мРНК) |
глутаматкарбоксипептидаза II (GCPII ), также известная как N-ацетил-L-аспартил-L-глутаматпептидаза I (NAALADase I), пептидаза NAAG или простатоспецифический мембранный антиген (PSMA ) представляет собой фермент, который у человека кодируется геном FOLH1 (фолатгидролаза 1 ) . GCPII человека содержит 750 аминокислот и весит приблизительно 84 кДа. GCPII представляет собой металлофермент цинка , который находится в мембранах. Большая часть фермента находится во внеклеточном пространстве. GCPII представляет собой мембранный гликопротеин класса II. Он катализирует гидролиз N-ацетиласпартилглутамата (NAAG) до глутамата и N-ацетиласпартата (NAA) в соответствии со схемой реакции справа. Нейробиологи в основном используют термин NAALADase в своих исследованиях, те, кто изучает метаболизм фолиевой кислоты, используют фолат гидролазу, а те, кто изучает рак простаты или онкологию, PSMA. Все они относятся к одной и той же протеин глутаматкарбоксипептидазе II. Содержание
Discovery GCPII в основном экспрессируется в четырех тканях тела, включая эпителий простаты, проксимальные канальцы почек, щеточную кайму тощей кишки тонкой кишки и ганглии нервных узлов. Действительно, первоначальное клонирование кДНК, кодирующей ген, экспрессирующий PSMA, было выполнено с помощью РНК из линии клеток опухоли простаты, LNCaP. PSMA имеет гомологию с рецептором трансферрина и подвергается эндоцитозу, но лиганд, индуцирующий интернализацию, не идентифицирован. Было обнаружено, что PSMA был таким же, как мембранный белок в тонком кишечнике, ответственный за удаление гамма-связанных глутаматов из полигаммаглутамат фолиевой кислоты. Это позволяет высвобождать фолиевую кислоту, которая затем может транспортироваться в организм для использования в качестве витамина. Это привело к клонированному геномному обозначению PSMA как FOLH1 для фолатгидролазы. PSMA (FOLH1) + фолат-полигаммаглутамат (n 1-7) --->PSMA (FOLH1) + фолат (поли) гаммаглутамат (n -1) + глутамат до высвобождения фолиевой кислоты. Структура Три домена внеклеточной части GCPII - протеазный, апикальный и С-концевой домены - взаимодействуют в распознавании субстрата. Протеазный домен представляет собой центральный семицепочечный смешанный β-лист. Β-лист окружен 10 α-спиралями. Апикальный домен расположен между первой и второй цепями центрального β-листа протеазного домена. Апикальный домен создает карман, который облегчает связывание субстрата. С-концевой домен представляет собой пучок с четырьмя спиралями вверх-вниз-вверх-вниз. Центральный карман имеет глубину примерно 2 нанометра и открывается из внеклеточного пространства в активный центр. Этот активный центр содержит два иона цинка. Во время ингибирования каждый действует как лиганд кислорода в 2-PMPA или фосфате. Есть также один ион кальция, координированный в GCPII, далеко от активного центра. Было высказано предположение, что кальций удерживает вместе протеазный и апикальный домены. Кроме того, GCPII человека имеет десять сайтов потенциального гликозилирования, и многие из этих сайтов (в том числе некоторые, расположенные далеко от каталитического домена) влияют на способность GCPII гидролизовать NAAG. Ген FOLH1 имеет несколько потенциальных стартовых сайтов и форм сплайсинга, что приводит к различиям в структуре мембранного белка, локализации и активности карбоксипептидазы в зависимости от исходной ткани. Кинетика фермента Гидролиз NAAG GCPII подчиняется Michaelis-Menten kinetics рассчитала константу связывания (K m) для NAAG как приблизительно 130 нМ, а константу оборота (k cat) как приблизительно 4 с. Кажущаяся константа скорости второго порядка составляет приблизительно 3 × 10 (М · с). Роль в развитии рака Человеческий PSMA высоко экспрессируется в простате, примерно в сто раз больше, чем в большинстве других тканей. При некоторых формах рака предстательной железы PSMA является вторым по активности генным продуктом с повышением в 8–12 раз по сравнению с уровнями в доброкачественных клетках простаты. Из-за этой высокой экспрессии PSMA разрабатывается как потенциальный биомаркер для терапии и визуализации некоторых видов рака. При раке простаты человека опухоли с более высокой степенью экспрессии связаны с более быстрым прогрессированием и большим процентом пациентов, страдающих рецидивом. Исследования in vitro с использованием клеточных линий рака простаты и молочной железы со сниженными уровнями PSMA показали значительное снижение пролиферации, миграции, инвазии, адгезии и выживаемости клеток. ImagingPSMA является целью нескольких ядерной медицины визуализирующих агентов для рака простаты. Экспрессия PSMA может быть отображена с помощью сканирования PSMA с галлием-68 для позитронно-эмиссионной томографии. Это использование представляет собой небольшую молекулу с радиоактивной меткой, которая с высокой аффинностью связывается с внеклеточным доменом рецептора PSMA. Ранее использовали антитело, нацеленное на внутриклеточный домен (капромабпентид индия-111, продаваемый как простацинт), хотя скорость обнаружения была низкой. В 2020 году были опубликованы результаты рандомизированного исследования фазы 3 («исследование ProPSMA»), в котором сравнивали ПЭТ / КТ с галлием-68 ПСМА и стандартные изображения (КТ и сканирование костей). Это исследование на 300 пациентов, проведенное в 10 исследованиях, продемонстрировало превосходную точность ПЭТ / КТ ПСМА (92% против 65%), более высокие значимые изменения в лечении (28% против 15%), менее двусмысленные / неопределенные результаты визуализации (7% против 23%). и более низкое радиационное воздействие (10 мЗв против 19 мЗв). В исследовании сделан вывод, что ПЭТ / КТ с ПСМА является подходящей заменой традиционной визуализации, обеспечивая превосходную точность комбинированных результатов КТ и сканирования костей. Эта новая технология в настоящее время оценивается для утверждения FDA. Терапевтическая цель (тераностика)PSMA также может быть использован экспериментально для нацеливания лечения. Лютеций-177 представляет собой бета-излучатель, связанный с PSMA для доставки лечения опухолей простаты. Проспективное исследование фазы II продемонстрировало активность (определяемую снижением уровня ПСА на 50% и более) у 64% мужчин. Общие токсические эффекты включают сухость во рту, сухую усталость, тошноту, сухость глаз и тромбоцитопению (снижение тромбоцитов). Ожидаются результаты рандомизированных исследований, включая исследование VISION фазы 3. Распад нейротрансмиттера Для тех, кто изучает заболевания нервной системы, NAAG является одним из трех наиболее распространенных нейротрансмиттеров, обнаруженных в центральной нервной системе, и когда он катализирует реакцию с образованием глутамата, он также производит другой нейротрансмиттер. Глутамат является распространенным возбуждающим нейромедиатором в центральной нервной системе; однако, если имеется слишком большая передача глутамата, это может убить или, по крайней мере, повредить нейроны и было вовлечено во многие неврологические заболевания и расстройства, поэтому баланс, в который вносит вклад пептидаза NAAG, очень важен. Возможные терапевтические применения Функция в головном мозгеБыло показано, что GCPII как косвенно, так и прямо увеличивает концентрацию глутамата во внеклеточном пространстве. GCPII напрямую расщепляет NAAG на NAA и глутамат. Было показано, что NAAG в высокой концентрации косвенно ингибирует высвобождение нейтротрансмиттеров, таких как ГАМК и глутамат. Это происходит за счет взаимодействия и активации пресинаптических mGluR группы II. Таким образом, в присутствии пептидазы NAAG, концентрация NAAG контролируется, а глутамат и ГАМК, среди других нейромедиаторов, не ингибируются. Исследователи смогли показать, что эффективные и селективные ингибиторы GCPII способны снижать уровень глутамата в головном мозге и даже обеспечивать защиту от апоптоза или деградации нейронов головного мозга на многих животных моделях инсульта, бокового амиотрофического склероза и невропатическая боль. Считается, что это ингибирование этих пептидаз NAAG, иногда называемых NP, обеспечивает эту защиту от апоптоза или деградации нейронов головного мозга за счет повышения концентрации NAAG в синапсах нейронов. Затем NAAG снижает высвобождение глутамата, одновременно стимулируя высвобождение некоторых трофических факторов из глиальных клеток в центральной нервной системе, что приводит к защите от апоптоза или деградации нейронов мозга. Однако важно отметить, что эти ингибиторы NP не оказывают никакого влияния на нормальную функцию глутамата. Ингибирование NP может улучшить естественную регуляцию вместо активации или ингибирования рецепторов, которые нарушили бы этот процесс. Исследования также показали, что низкомолекулярные ингибиторы NP полезны на животных моделях, имеющих отношение к нейродегенеративным заболеваниям. Некоторые конкретные применения этого исследования включают невропатическую и воспалительную боль, черепно-мозговую травму, ишемический инсульт, шизофрению, диабетическую невропатию, боковой амиотрофический склероз, а также наркоманию. Предыдущие исследования показали, что препараты, снижающие передачу глутамата, могут облегчить невропатическую боль, хотя возникающие побочные эффекты ограничивают их клиническое применение. Таким образом, похоже, что, поскольку GCPII задействуется исключительно с целью обеспечения источника глутамата при гиперглутаматергических и эксайтотоксических состояниях, это может быть альтернативой предотвращению этих побочных эффектов. Другие результаты исследований показали, что гидролиз NAAG нарушается при шизофрении, и они показали, что определенные анатомические области мозга могут даже демонстрировать дискретные отклонения в синтезе GCP II, поэтому NP также могут быть терапевтическими для пациентов, страдающих шизофренией. Одним из основных препятствий при использовании многих мощных ингибиторов GCPII, которые были приготовлены на сегодняшний день, являются, как правило, высокополярные соединения, что вызывает проблемы, потому что они не проникают легко через гематоэнцефалический барьер. Возможные применения пептидазы NAAG ингибиторыГлутамат является «основным возбуждающим нейромедиатором в нервной системе человека», участвующим во множестве функций мозга. Известно, что чрезмерная стимуляция и активация глутаматных рецепторов, а также «нарушения клеточных механизмов, защищающих от неблагоприятных последствий физиологической активации глутаматных рецепторов» вызывают повреждение и смерть нейронов, которые были связаны с множеством неврологических заболеваний. 33> Из-за диапазона функции и присутствия глутамата было трудно создать глутаматергические препараты, которые не влияли бы отрицательно на другие необходимые функции и не вызывали бы нежелательных побочных эффектов. Ингибирование пептидазы NAAG открыло возможность для нацеливания на конкретное лекарство. Специфические ингибиторыИнгибиторы NAAG-пептидазы были широко созданы и изучены с момента появления надежды на возможное лечение неврологических заболеваний и нацеливание на специфические лекарственные препараты. Ниже приведены несколько примеров небольших молекул:
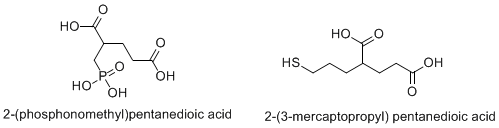 Структуры двух общих ингибиторов: 2-PMPA и 2-MPPA Структуры двух общих ингибиторов: 2-PMPA и 2-MPPA Другие возможные терапевтические примененияНейропатическая и воспалительная больБоль, вызванная повреждением ЦНС или ПНС, связана с повышением концентрации глутамата. Ингибирование NAAG снижает присутствие глутамата и, таким образом, может уменьшить боль. (Neale JH et al., 2005). Nagel et al. использовали ингибитор 2-PMPA, чтобы показать анальгетический эффект ингибирования пептидазы NAAG. За этим исследованием последовало исследование Чена и др., Которое показало аналогичные результаты. Травма головыТяжелая травма головы (SHI) и черепно-мозговая травма (TBI) широко распространены и оказывают огромное влияние. «Они являются основной причиной смерти детей и молодых людей (<25 years) and account for a quarter of all deaths in the five to 15 years age group”. Following initial impact, glutamate levels rise and cause excitotoxic damage in a process that has been well characterized. With its ability to reduce glutamate levels, NAAG inhibition has shown promise in preventing neurological damage associated with SHI and TBI. ИнсультПо данным Национальной ассоциации инсультов, инсульт является третьей по значимости причиной смерти и основной причиной смерти. инвалидности у взрослых. Считается, что уровни глутамата вызывают основное ишемическое повреждение во время инсульта, и, таким образом, ингибирование NAAG может уменьшить это повреждение. ШизофренияШизофрения - психическое расстройство это поражает 1% людей во всем мире. Его можно смоделировать с помощью PCP на лабораторных животных, и было показано, что агонисты mGluR снижают действие препарата. NAAG, таким образом, является агонистом mGluR. Таким образом, ингибирование фермент, который снижает концентрацию NAAG, пептидаза NAAG, может обеспечить практическое лечение для уменьшения симптомов шизофрении. Диабетическая невропатияДиабет может привести к повреждению нервов, вызывая потерю чувствительности, боль или если вегетативные нервы связаны, повреждение кровеносных, репродуктивных, o пищеварительной системы, среди прочего. Сообщается, что более 60% пациентов с диабетом страдают той или иной формой невропатии, однако степень ее тяжести значительно варьируется. Невропатия не только напрямую причиняет вред и ущерб, но также может косвенно привести к таким проблемам, как диабетические язвы, которые, в свою очередь, могут привести к ампутации. Фактически, более половины всех ампутаций нижних конечностей в Соединенных Штатах приходится на пациентов с диабетом. Благодаря использованию ингибитора пептидазы NAAG 2-PMPA, расщепление NAAG было ингибировано и, вместе с тем, запрограммировано нейронное соединение DRG. гибель клеток при высоком уровне глюкозы. Исследователи предположили, что причиной этого является агонистическая активность NAAG в отношении mGluR3. Кроме того, NAAG также «предотвращал индуцированное глюкозой ингибирование роста нейритов» (Berent-Spillson, et al. 2004). В целом, это делает ингибирование GCPIII четкой модельной мишенью для борьбы с диабетической невропатией. НаркоманияШизофрения, как описано ранее, обычно моделируется в лаборатории с помощью модели на животных PCP. Поскольку было показано, что ингибирование GCPIII, возможно, ограничивает шизофреническое поведение в этой модели, это предполагает, что ингибирование GCPIII, таким образом, снижает эффект PCP. Кроме того, было показано, что вознаграждающее действие многих наркотиков (кокаина, PCP, алкоголя, никотина и т. Д.) Связано с уровнями глутамата, на которые NAAG и GCPIII могут оказывать регулирующее воздействие. <161 Подводя итог, можно сделать вывод о результатах многочисленных исследований лекарственных препаратов, в которых делается вывод о том, что:
Другие заболевания и расстройстваИнгибирование NAAG также изучалось в качестве лечения рака простаты, БАС и других нейродегенеративных заболеваний, таких как болезнь Паркинсона и Болезнь Хантингтона. Ссылки Внешние ссылки
Последняя правка сделана 2021-05-21 11:22:02
Содержание доступно по лицензии CC BY-SA 3.0 (если не указано иное). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||