| ДНК-примаза | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Организм | E. coli K-12 substr. MG1655, Bacillus stearothermophilus | ||||||
| Символ | dnaG | ||||||
| Альт. символы | dnaP | ||||||
| Entrez | 947570 | ||||||
| PDB | 1D0Q, 1DD9, 1DDE, 1EQ9, 2R6A, 2R6C | ||||||
| RefSeq (Prot) | NP_417538 | ||||||
| UniProt | P0ABS5 | ||||||
| Другие данные | |||||||
| Номер EC | 2.7.7.7 | ||||||
| Хромосома | хромосома: 3,21 - 3,21 Mb | ||||||
| |||||||
DnaG представляет собой бактериальную ДНК примазу и кодируется геном dnaG. Фермент DnaG и любая другая ДНК-примаза синтезирует короткие цепи РНК, известные как олигонуклеотиды, во время репликации ДНК. Эти олигонуклеотиды известны как праймеры, потому что они действуют как отправная точка для синтеза ДНК. DnaG катализирует синтез олигонуклеотидов длиной от 10 до 60 нуклеотидов (основная единица ДНК и РНК), однако большинство синтезированных олигонуклеотидов имеют длину 11 нуклеотидов. Эти олигонуклеотиды РНК служат праймерами или отправными точками для синтеза ДНК бактериальной ДНК-полимеразой III (Pol III). DnaG важен для репликации бактериальной ДНК, поскольку ДНК-полимераза не может инициировать синтез цепи ДНК, а может только добавлять нуклеотидов к уже существующей цепи. DnaG синтезирует единственный праймер РНК в ориджине репликации. Этот праймер служит для инициации синтеза ведущей цепи ДНК. Для другой родительской цепи, отстающей цепи, DnaG синтезирует праймер РНК каждые несколько килобаз (т.п.н.). Эти праймеры служат субстратами для синтеза фрагментов Окадзаки.
. В E. coli DnaG связывается за счет нековалентных взаимодействий с бактериальной репликативной геликазой DnaB для выполнения своей праймазной активности с три белка примазы DnaG, связывающиеся с каждой геликазой DnaB, с образованием примосомы. Примазы, как правило, инициируют синтез трех конкретных нуклеотидных последовательностей на матрицах одноцепочечной ДНК (оцДНК), а для E.coli DnaG последовательность представляет собой 5'-CTG-3 '.
DnaG содержит три отдельных белка домены : домен связывания цинка, домен РНК-полимеразы и домен связывания геликазы DnaB. Есть несколько бактерий, которые используют ДНК-примазу DnaG. Несколько организмов, имеющих DnaG в качестве ДНК-примазы, - это Escherichia coli (E. coli), Bacillus stearothermophilus и Mycobacterium tuberculosis (MTB). E. coli DnaG имеет молекулярную массу 60 килодальтон (кДа) и содержит 581 аминокислот.
 DnaG (ДНК-примаза) является важным фермент, участвующий в репликационной вилке ДНК
DnaG (ДНК-примаза) является важным фермент, участвующий в репликационной вилке ДНК 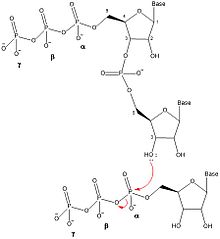 Органический механизм олигонуклеотидного синтеза рибонуклеиновой кислоты (РНК) в направлении от 5 'до 3'
Органический механизм олигонуклеотидного синтеза рибонуклеиновой кислоты (РНК) в направлении от 5 'до 3' DnaG катализирует синтез олигонуклеотидов в пяти дискретных стадиях: связывание с матрицей, нуклеозид связывание, инициация, удлинение трифосфата (NTP) с образованием праймера и перенос праймера на ДНК-полимеразу III. DnaG выполняет этот катализ вблизи репликационной вилки, которая образуется геликазой DnaB во время репликации ДНК. DnaG должен быть в комплексе с DnaB, чтобы он мог катализировать образование олигонуклеотидных праймеров.
Механизм синтеза праймеров с помощью праймаз включает два сайта связывания NTP на протеине прайма (DnaG). Перед связыванием любых NTP с образованием праймера РНК матричная последовательность оцДНК связывается с DnaG. ОцДНК содержит трехнуклеотидную последовательность распознавания, которая рекрутирует NTP на основе спаривания оснований Уотсона-Крика. После связывания ДНК DnaG должен связывать два NTP, чтобы образовать четвертичный комплекс фермент-ДНК-NTP-NTP. Константа Михаэлиса (км) для NTP варьируется в зависимости от примазы и шаблонов. Два сайта связывания NTP на DnaG называются сайтом инициации и сайтом элонгации. Сайт инициации - это сайт, с которым связывается NTP, который должен быть включен на 5'-конце праймера. Сайт элонгации связывает NTP, который добавлен к 3'-концу праймера.
Как только два нуклеотида связываются с примазой, DnaG катализирует образование динуклеотида путем образования фосфодиэфирной связи посредством дегидратационного синтеза между 3'-гидроксилом нуклеотида в сайте инициации и α-фосфат нуклеотида в участке элонгации. Эта реакция приводит к образованию динуклеотида и разрыву связи между α и β фосфором с высвобождением пирофосфата. Эта реакция необратима, поскольку образующийся пирофосфат гидролизуется на две молекулы неорганического фосфата под действием фермента неорганической пирофосфатазы. Эта реакция синтеза динуклеотидов аналогична реакции любого другого фермента, который катализирует образование ДНК или РНК (ДНК-полимераза, РНК-полимераза ), поэтому DnaG всегда должен синтезировать олигонуклеотиды в 5 ' в направлении 3 '. В E. coli праймеры начинаются с динуклеотида трифосфат-аденин-гуанина (pppAG) на 5'-конце.
Для того, чтобы произошло дальнейшее удлинение динуклеотида, олигонуклеотид должен быть перемещен так, чтобы 3'-NTP переносился с сайта элонгации на сайт инициации, позволяя другому NTP связываться с сайтом удлинения и присоединяться к 3'-гидроксилу олигонуклеотида. Как только олигонуклеотид подходящей длины был синтезирован на стадии элонгации синтеза праймера, DnaG переносит вновь синтезированный праймер на ДНК-полимеразу III, чтобы он синтезировал ведущую цепь ДНК или фрагменты Окадзаки для отстающей цепи. Ограничивающая скорость стадия синтеза праймера происходит после связывания NTP, но до или во время синтеза динуклеотидов.
Примаза E. Coli DnaG представляет собой мономерный белок из 581 остатка с тремя функциональными доменами, согласно к исследованиям протеолиза. Существует N-концевой цинк-связывающий домен (остатки 1–110), где ион цинка тетраэдрически координирован между одним гистидином и тремя остатками цистеина, который играет роль в распознавании сайтов связывания ДНК, специфичных для последовательности. Центральный домен (остатки 111-433) демонстрирует активность РНК-полимеразы и является местом синтеза праймера РНК. С-концевой домен (остатки 434-581) отвечает за нековалентное связывание DnaG с белком DnaB-геликазы.
 Слева: структура Bacillus stearothermophilus цинк-связывающий домен с консервативными гидрофобными и основными остатками, показанными серебром. Справа: увеличенное изображение сайта связывания цинка, на котором показаны Cys40, Cys61, Cys64 и His43, координирующие ион цинка. Диаграмма, полученная из PDB 1D0Q.
Слева: структура Bacillus stearothermophilus цинк-связывающий домен с консервативными гидрофобными и основными остатками, показанными серебром. Справа: увеличенное изображение сайта связывания цинка, на котором показаны Cys40, Cys61, Cys64 и His43, координирующие ион цинка. Диаграмма, полученная из PDB 1D0Q.Цинк-связывающий домен, домен, ответственный за распознавание участков связывания ДНК, специфичных для последовательности, является консервативным для всех вирусных, бактериофаговых, прокариотических и эукариотических ДНК-примаз. Цинк-связывающий домен примазы является частью подсемейства цинк-связывающих доменов, известного как цинковая лента. Цинковые ленточные домены характеризуются двумя петлями β-шпильки, которые образуют цинк-связывающий домен. Обычно считается, что в доменах ленты цинка отсутствуют α-спирали, что отличает их от других доменов, связывающих цинк. Однако в 2000 г. цинк-связывающий домен DnaG был кристаллизован из Bacillus stearothermophilus, что показало, что этот домен состоит из пятицепочечного антипараллельного β-листа, прилегающего к четырем α-спиралям и 310спирали на c-конце домена.
Цинк-связывающий сайт B. stearothermophilus состоит из трех остатков цистеина, Cys40, Cys61 и Cys64, и одного остатка гистидина, His43. Cys40 и His43 расположены на β-шпильке между вторым и третьим β-листом. Cys61 расположен на пятом β-листе, а Cys64 находится на β-шпильке между четвертым и пятым β-листом. Эти четыре остатка координируют ион цинка тетраэдрически. Считается, что ион цинка стабилизирует петли между вторым и третьим β-слоями, а также четвертым и пятым β-слоями. Домен дополнительно стабилизируется за счет ряда гидрофобных взаимодействий между гидрофобной внутренней поверхностью β-листа, который упакован относительно второй и третьей α-спиралей. На внешней поверхности β-листа также имеется много консервативных гидрофобных и основных остатков. Эти остатки представляют собой Lys30, Arg34, Lys46, Pro48, Lys56, Ile58, His60 и Phe62.
Считается, что функция домена связывания цинка заключается в распознавании специфической ДНК последовательности.. Примазы ДНК создают праймеры РНК, которые затем используются для синтеза ДНК. Размещение праймеров РНК не случайно, что позволяет предположить, что они размещены на определенных последовательностях ДНК. Действительно, было показано, что другие ДНК-примазы распознают триплетные последовательности; конкретная последовательность, распознаваемая B. stearothermophilus, еще не идентифицирована. Было показано, что при мутации остатков цистина, координирующих ион цинка, ДНК-примаза перестает функционировать. Это указывает на то, что цинк-связывающий домен действительно играет роль в распознавании последовательности. Кроме того, гидрофобная поверхность β-листа, а также основные остатки, которые сгруппированы в основном на одном крае листа, служат для привлечения одноцепочечной ДНК, дополнительно облегчая связывание ДНК.
На основании предыдущих исследований. Из-за связывания ДНК ДНК-примазами считается, что ДНК связывается с цинк-связывающим доменом на поверхности β-листа, при этом три нуклеотида связываются через три нити β-листа. Положительно заряженные остатки в листе могли бы образовывать контакты с фосфатами, а ароматические остатки могли бы образовывать стэкинг-взаимодействия с основаниями. Это модель связывания ДНК оцДНК-связывающим доменом репликационного белка А (RPA). Логично предположить, что цинк-связывающий домен B. stearothermophilus связывает ДНК аналогичным образом, поскольку остатки, важные для связывания ДНК в RPA, находятся в структурно эквивалентных положениях в B. stearothermophilus.
 Структура домена РНК-полимеразы DnaG E. coli. Высококонсервативные основные остатки Arg146, Arg221 и Lys229 показаны желтым цветом. Это изображение было визуализировано из PDB 1DD9.
Структура домена РНК-полимеразы DnaG E. coli. Высококонсервативные основные остатки Arg146, Arg221 и Lys229 показаны желтым цветом. Это изображение было визуализировано из PDB 1DD9.. Как следует из названия, домен РНК-полимеразы (RNAP) DnaG отвечает за синтез праймеров РНК на одноцепочечной ДНК. In vivo DnaG может синтезировать фрагменты праймеров длиной до 60 нуклеотидов, но фрагменты праймеров in vivo ограничены приблизительно 11 нуклеотидами. Во время синтеза отстающей цепи DnaG синтезирует от 2000 до 3000 праймеров со скоростью один праймер в секунду.
RNAP-домен DnaG имеет три субдомена, N-концевой домен, который имеет смешанную α- и β-складку, центральный домен, состоящий из 5-нитевого β-листа и 6 α-спиралей, и, наконец, C-концевой домен, который состоит из спирального пучка, состоящего из 3 антипараллельных α спирали. Центральный домен образован частью верхней складки, складки, которая наблюдалась во многих металл-связывающих белках фосфотрансфера. Центральный домен и N-концевой домен образуют неглубокую щель, которая составляет активный сайт удлинения цепи РНК в DnaG. Открытие щели выстлано несколькими высококонсервативными основными остатками: Arg146, Arg221 и Lys229. Эти остатки являются частью электростатически положительного гребня N-концевого субдомена. Именно этот гребень взаимодействует с оцДНК и помогает направлять ее в щель, которая состоит из центра связывания металла мотива топрима в центральном субдомене и консервативных мотивов примазы N-концевого домена. Сайт связывания металла топрим-домена - это место, где синтезируется праймер. Затем дуплекс РНК: ДНК проходит через еще одну базовую депрессию.
 Структура домена связывания геликазы E. Coli. Визуализировано из PDB 2R6A. Две нижние спирали образуют спиральную шпильку субдомена C2. Остальные пять спиралей образуют спиральный пучок субдомена С1.
Структура домена связывания геликазы E. Coli. Визуализировано из PDB 2R6A. Две нижние спирали образуют спиральную шпильку субдомена C2. Остальные пять спиралей образуют спиральный пучок субдомена С1. В отличие от доменов связывания цинка и доменов РНК-полимеразы, С-концевые домены праймаз ДНК не консервативны. В прокариотических примазах единственной известной функцией этого домена является взаимодействие с геликазой, DnaB. Таким образом, этот домен называется доменом связывания геликазы (HBD). HBD DnaG состоит из двух субдоменов: спирального пучка , субдомена C1, и спиральной шпильки, субдомена C2. Для каждой из двух-трех молекул DnaG, которые связывают гексамер DnaB, субдомены C1 HBD взаимодействуют с DnaB в его N-концевых доменах на внутренней поверхности гексамерного кольца, в то время как субдомены C2 взаимодействуют с N-концевыми доменами. на внешней поверхности гексамера.
 Bacillus stearothermophilus DnaG, синий, в комплексе с гексамерным DnaB, зеленый. Получено из PDB 2R6A
Bacillus stearothermophilus DnaG, синий, в комплексе с гексамерным DnaB, зеленый. Получено из PDB 2R6A Три остатка в DnaB B. stearothermophilus были идентифицированы как важные для образования интерфейса DnaB, DnaG. Эти остатки включают Tyr88, Ile119 и Ile125. Tyr88 находится близко к HBD DnaG, но не контактирует с ним. Мутация Tyr88 ингибирует образование спирального пучка N-концевого домена DnaB, прерывая контакты с HBD DnaG. Гексамерная структура DnaB на самом деле представляет собой тример димеров. И Ile119, и Ile125 скрыты в интерфейсе димера N-концевого домена DnaB, и мутация этих остатков ингибирует образование гексамерной структуры и, следовательно, взаимодействие с DnaG. Еще один остаток, который, как было установлено, играет решающую роль во взаимодействии DnaB и DnaG, - это Glu15. Мутация Glu15 не нарушает образование комплекса DnaB, DnaG, но вместо этого играет роль в модуляции длины праймеров, синтезируемых DnaG.
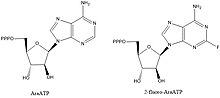 аналогов NTP, которые, как известно, ингибируют DnaG а также другие ферменты полимеразы
аналогов NTP, которые, как известно, ингибируют DnaG а также другие ферменты полимеразы Ингибиторы ДНК-примаз являются ценными соединениями для выяснения биохимических путей и ключевых взаимодействий, но они также представляют интерес как ведущие соединения для создания лекарств против бактериальных заболеваний. Большинство соединений, которые, как известно, ингибируют примазы, представляют собой аналоги нуклеотидов, такие как AraATP (см. Vidarabine ) и 2-фтор-AraATP. Эти соединения часто будут использоваться праймазой в качестве субстратов, но после включения синтез или удлинение больше не могут происходить. Например, DnaG E. coli будет использовать 2 ', 3'-дидезоксинуклеозид 5'-трифосфаты (ddNTP) в качестве субстратов, которые действуют как терминаторы цепи из-за отсутствия 3'-гидроксила для образования фосфодиэфира. связь со следующим нуклеотидом.
Относительно небольшое количество ингибиторов примазы, вероятно, отражает сложность, присущую анализам примазы, а не отсутствие потенциальных сайтов связывания на ферменте. Короткая длина синтезируемых продуктов и, как правило, более низкая скорость фермента по сравнению с другими ферментами репликации затрудняют разработку подходов высокопроизводительного скрининга (HTS). Несмотря на трудности, существует несколько известных ингибиторов DnaG, не являющихся аналогами NTP. Доксорубицин и сурамин являются конкурентными ингибиторами Mycobacterium Tuberculosis DnaG как ДНК, так и NTP. Также известно, что сурамин ингибирует эукариотическую ДНК-примазу, конкурируя с GTP, поэтому сурамин, вероятно, ингибирует DnaG через аналогичный механизм.