 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Кипролис |
| Другие названия | PX-171-007 |
| Данные лицензии |
|
| Беременность. категория |
|
| Способы. введения | Внутривенно |
| Код ATC | |
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Связывание с белками | 97% |
| Metabo lism | Обширный; CYP играет второстепенную роль |
| Идентификаторы | |
Имя ИЮПАК
| |
| Номер CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBLL <19018> | |
| CompTox Dashboard (EPA ) | |
| ECHA InfoCard | 100.219.957 |
| Химические и физические данные | |
| Формула | C40H57N5O7 |
| Молярная масса | 719,924 г · mol |
| 3D-модель (JSmol ) | |
УЛЫБКИ
| |
InChI
| |
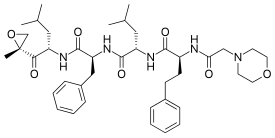
Карфилзомиб (продается под торговым названием Kyprolis, разработанный Onyx Pharmaceuticals ) представляет собой противораковый препарат, действующий как селективный ингибитор протеасом. По химическому составу это тетрапептид эпоксикетон и аналог эпоксомицина.
США. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило его 20 июля 2012 года для использования у пациентов с множественной миеломой, которые ранее получали не менее двух курсов лечения, включая лечение бортезомибом и иммуномодулирующая терапия (например, леналидомид ) и продемонстрировали прогрессирование заболевания на или в течение 60 дней после завершения последней терапии. Первоначальное одобрение было основано на количестве откликов. Данные, демонстрирующие преимущество общей выживаемости (ОС), были позже продемонстрированы в исследовании ENDEAVOR и одобрены FDA.
Аббревиатура CFZ обычно используется для обозначения карфилзомиба, но сокращенные названия лекарств не используются. передовой опыт в медицине.
Карфилзомиб является производным эпоксомицина, натурального продукта, который, как было показано лабораторией Craig Crews в Йельском университете, ингибирует протеасому. Лаборатория Крюса впоследствии изобрела более конкретное производное эпоксомицина, названное YU101, которое было лицензировано Proteolix, Inc. Ученые из Proteolix изобрели новое, отличное соединение, которое потенциально могло использоваться в качестве лекарственного средства для людей, известное как карфилзомиб.. Proteolix продвинул карфилзомиб в несколько фаз 1 и 2 клинических испытаний, включая ключевое клиническое исследование фазы 2, направленное на поиск ускоренного утверждения. Клинические испытания карфилзомиба продолжаются в компании Onyx Pharmaceuticals, которая приобрела Proteolix в 2009 году.
В январе 2011 года FDA предоставило карфилзомибу ускоренный статус, что позволило Onyx инициировать непрерывная подача заявки на новый препарат карфилзомиб. В декабре 2011 года FDA предоставило Onyx статус стандартного обзора для подачи заявки на новое лекарство на основе исследования 003-A1, открытого исследования фазы 2b с одной группой. В исследовании участвовали 266 пациентов с рецидивирующей и рефрактерной множественной миеломой, которые ранее получали лечение по меньшей мере двумя способами, включая бортезомиб и талидомид или леналидомид. Это стоит примерно 10 000 долларов за 28-дневный цикл.
Карфилзомиб ковалентно необратимо связывается и ингибирует химотрипсин -подобную активность протеасомы 20S, фермент, разрушающий нежелательные клеточные белки. Карфилзомиб минимально взаимодействует с непротеасомными мишенями, что улучшает профили безопасности по сравнению с бортезомибом. Ингибирование протеасом-опосредованного протеолиза приводит к накоплению полиубиквитинированных белков, что может вызывать остановку клеточного цикла, апоптоз и ингибирование роста опухоли.
Одноэтапное исследование фазы II (003-A1) карфилзомиба у пациентов с рецидивной и рефрактерной множественной миеломой показало, что монотерапия карфилзомибом продемонстрировала клиническую эффективность 36% в группе 266 пациентов прошли оценку, и общая частота ответа составила 22,9%, а средняя продолжительность ответа - 7,8 месяцев. Одобрение карфилзомиба FDA было основано на результатах исследования 003-A1.
В исследовании фазы II (004) карфилзомиб имел общую эффективность 53% среди пациентов с рецидивирующей и / или рефрактерной множественной миеломой, которые ранее не получал бортезомиб. Это исследование также включало когорту пациентов, принимавших бортезомиб. Результаты сообщались отдельно. Это исследование также показало, что длительное лечение карфилзомибом было переносимым, примерно 22% пациентов продолжали лечение дольше одного года. Исследование 004 было меньшим по размеру исследованием, первоначально разработанным для изучения влияния лечения карфилзомибом на лечение бортезомибом у пациентов с менее интенсивным предварительным лечением (1–3 предыдущие схемы).
Испытание фазы II (005), в котором проводилась оценка безопасность, фармакокинетика, фармакодинамика и эффективность карфилзомиба у пациентов с множественной миеломой и различной степенью почечной недостаточности, когда почти 50% пациентов были резистентны как к бортезомибу, так и к леналидомиду, продемонстрировали, что фармакокинетика и безопасность не зависели от степени исходного уровня. почечная недостаточность. Карфилзомиб переносился и продемонстрировал эффективность.
В другом исследовании фазы II (006) с участием пациентов с рецидивирующей и / или рефрактерной множественной миеломой карфилзомиб в комбинации с леналидомидом и дексаметазоном продемонстрировал общий ответ 69%.
Исследование фазы II (007) множественной миеломы и солидных опухолей показало многообещающие результаты.
В исследованиях фазы II карфилзомиба наиболее частыми побочными эффектами 3 степени и выше, возникающими при лечении, были гематологическая токсичность с тромбоцитопения, анемия, лимфопения, нейтропения, пневмония, утомляемость и гипонатриемия.
В предварительном исследовании фазы I / II комбинация карфилзомиба, леналидомида и низких доз дексаметазона была высокоактивной. и хорошо переносится, что позволяет использовать полные дозы в течение длительного времени у пациентов с впервые диагностированной множественной миеломой с ограниченной потребностью в изменении дозы. Ответы были быстрыми и улучшались с течением времени, достигая 100% очень хорошего частичного ответа.
Кроме того, желудочно-кишечные расстройства, включая диарею и тошноту, не являются гематологической группой побочных эффектов, обычно наблюдаемых при применении ингибиторов протеасом. Кроме того, сердечно-сосудистая токсичность может быть результатом лечения карфилзомибом из-за воздействия на протеасомы в миокарде. Таким образом, оценка пациента и оценка риска до начала терапии карфилзомибом имеют решающее значение.
Подтверждающее клиническое исследование фазы III, известное как исследование ASPIRE, в котором сравниваются карфилзомиб, леналидомид и дексаметазон. по сравнению с леналидомидом и дексаметазоном у пациентов с рецидивирующей множественной миеломой. Его результаты были представлены на встрече Американского общества гематологов в декабре 2014 г. Они показали, что значительно больше пациентов ответили на схему из трех препаратов, чем на схему из двух препаратов. Промежуточные результаты исследования ASPIRE были опубликованы в Медицинском журнале Новой Англии.