| Белок A | |||||||
|---|---|---|---|---|---|---|---|
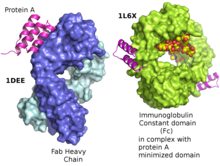 Структура домена белка A в виде трехспирального пучка, связывающегося с тяжелой вариабельной цепью VH3 человек Fab ушел. Минимизированный белок A, связанный с Fc-фрагментом ритуксимаба. Структура домена белка A в виде трехспирального пучка, связывающегося с тяжелой вариабельной цепью VH3 человек Fab ушел. Минимизированный белок A, связанный с Fc-фрагментом ритуксимаба. | |||||||
| Идентификаторы | |||||||
| Symbol | SpA | ||||||
| SCOPe | 1DEE / SUPFAM | ||||||
| |||||||
Белок A представляет собой поверхностный белок 42 кДа, первоначально обнаруженный в клетке. стенка бактерий Staphylococcus aureus. Он кодируется геном spa, и его регуляция контролируется топологией ДНК, осмолярностью клетки и двухкомпонентной системой, называемой ArlS-ArlR. Он нашел применение в биохимических исследованиях из-за его способности связывать иммуноглобулины. Он состоит из пяти гомологичных Ig-связывающих доменов, которые складываются в трехспиральный пучок. Каждый домен способен связывать белки многих видов млекопитающих, в первую очередь IgG. Он связывает тяжелую цепь в Fc-области большинства иммуноглобулинов, а также в Fab-области в случае человеческого семейства VH3. Благодаря этим взаимодействиям в сыворотке, где молекулы IgG связаны в неправильной ориентации (относительно нормальной функции антитела ), бактерии нарушают опсонизацию и фагоцитоз.
В качестве побочного продукта своей работы над типоспецифичными антигенами стафилококка Вервей сообщил в 1940 году, что белковая фракция, полученная из экстрактов этих бактерий, неспецифически осаждала кроличьи антисыворотки против различных виды стафилококков. В 1958 году Дженсен подтвердил открытие Вервея и показал, что сыворотки до иммунизации кроликов, а также нормальные сыворотки человека связываются с активным компонентом экстракта стафилококка; он обозначил этот компонент как антиген А (потому что он был обнаружен во фракции А экстракта), но думал, что это полисахарид. Ошибочная классификация белка была результатом ошибочных тестов, но вскоре после этого (1962 г.) Лёфквист и Шёквист исправили ошибку и подтвердили, что антиген А на самом деле является поверхностным белком на бактериальной стенке некоторых штаммов S. aureus. Группа Бергена из Норвегии назвала белок «Белком А» в честь фракции антигена, выделенной Йенсеном.
С помощью кристаллографического уточнения было показано, что первичный сайт связывания для белка A находится в области Fc, между доменами CH2 и CH3. Кроме того, было показано, что протеин A связывает молекулы человеческого IgG, содержащие фрагменты IgG F (ab ') 2 из семейства генов VH3 человека.
Белок A может связываться с сильным сродством с Fc-частью иммуноглобулина определенных виды, как показано в таблице ниже.
| Виды | Подкласс | Связывание |
|---|---|---|
| Человеческий | IgA | переменная |
| IgD | слабый или отсутствует | |
| IgE | слабый или отсутствует | |
| IgG 1 | сильный | |
| IgG 2 | сильный | |
| IgG 3 | слабый или отсутствует | |
| IgG 4 | сильный | |
| IgM | переменная | |
| желток птичьего яйца | IgY | слабый или отсутствует |
| бычий | средний | |
| собачий | средний | |
| Козий | слабый или отсутствует | |
| Морская свинка | IgG 1 | сильный |
| Хомяк | слабый | |
| Лошадь | средний | |
| Коала | слабый или нет | |
| Лама | слабый или нет | |
| Обезьяна (резус) | сильный | |
| Мышиный | IgG 1 | слабый |
| IgG 2a | сильный | |
| IgG 2 | от среднего до сильного | |
| IgG 3 | среднего | |
| IgM | переменного | |
| Свиньи | от среднего до сильного | |
| Кролик | сильный | |
| Крыса | IgG 1 | слабый или нет |
| IgG 2a | слабый или нет | |
| IgG 2b | слабый или нет | |
| IgG 3 | слабый | |
| Овца | слабая или отсутствует |
В дополнение к протеину A, другие иммуноглобулин-связывающие бактериальные протеины, такие как протеин G, протеин A / G и Белок L обычно используются для очистки, иммобилизации или обнаружения иммуноглобулинов.
В качестве патогена Staphylococcus aureus использует протеин A, наряду с множеством других протеинов и поверхностных факторов, чтобы способствовать его выживанию и вирулентности. С этой целью белок A играет многогранную роль:
Белок A помогает подавить поглощение фагоцитами и действует как иммунологическая маскировка. Более высокие уровни протеина A в различных штаммах S. aureus были связаны с носительством этих бактерий через нос.
Мутанты S. aureus, лишенные протеина A, более эффективно фагоцитируются in vitro, а количество мутантов в моделях инфекции уменьшилось. вирулентность.
Белок A производится и очищается в ходе промышленной ферментации для использования в иммунологии, биологических исследованиях и промышленных применениях (см. ниже). Природный (или нативный) белок A можно культивировать в Staphylococcus aureus, и он содержит пять гомологичных областей связывания антител, описанных выше, и C-концевую область для прикрепления к клеточной стенке. Сегодня протеин А чаще вырабатывается рекомбинантно в Escherichia coli. (Brevibacillus также оказался эффективным хозяином.) Рекомбинантные версии протеина A также содержат пять гомологичных связывающих доменов антител, но могут различаться в других частях структуры для облегчения связывания с пористыми субстратами. также доступны версии этого белка, первым из которых был rProtein A, B4, C-CYS. Спроектированные версии представляют собой мультимеры (обычно тетрамеры, пентамеры или гексамеры) одного домена, который был модифицирован для повышения удобства использования в промышленных приложениях.
Белок A часто соединяется с другими молекулами, такими как флуоресцентный краситель, ферменты, биотин, коллоидное золото или радиоактивный йод, не влияя на сайт связывания антител. Примеры, в том числе окрашивание белок A – золото (PAG), используется в маркировке иммунным золотом, белок А, связанный с флуорофором, для иммунофлуоресценции и белок А, связанный с стыковочной цепью ДНК, для визуализации ДНК-PAINT. Он также широко используется в сочетании с магнитными, латексными и агарозными гранулами.
Белок А часто иммобилизуют на твердой подложке и используют в качестве надежного метода очистки общего IgG из смесей сырых белков, таких как сыворотка или асцитная жидкость, или в сочетании с один из вышеперечисленных маркеров для определения наличия антител. Первый пример соединения протеина А с пористой гранулой для очистки IgG был опубликован в 1972 году. Иммунопреципитация исследования с протеином А, конъюгированным с гранулами, также обычно используются для очистки белков или белковых комплексов косвенно через антитела против представляющий интерес белок или белковый комплекс.
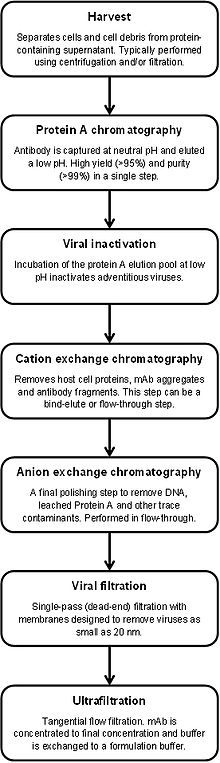 Эта блок-схема процесса показывает, как моноклональные антитела обычно очищаются в промышленном масштабе.
Эта блок-схема процесса показывает, как моноклональные антитела обычно очищаются в промышленном масштабе. Первое упоминание в литературе коммерчески доступной смолы для хроматографии на основе протеина А появилось в 1976 г. Сегодня хроматографическое разделение с использованием протеина А, иммобилизованного на пористых субстратах, является наиболее широко распространенным методом очистки моноклональных антител (mAb) из супернатанта культуры клеток. Выбор протеина А в качестве предпочтительного метода обусловлен высокой чистотой и выходом, которые легко и надежно достигаются. Это формирует основу для общей «платформы» очистки антител, которая упрощает производственные операции и сокращает время и усилия, необходимые для разработки процессов очистки. Типичный процесс очистки mAb показан справа. Несмотря на долгую историю использования хроматографии на протеине А для производства антител, этот процесс все еще совершенствуется сегодня. Непрерывная хроматография, точнее периодическая противоточная хроматография, значительно увеличивает производительность стадии очистки.