 | |
 | |
| Имена | |
|---|---|
Другие имена
| |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.008.527 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C32H18N8 |
| Молярная масса | 514,552 г · моль |
| Опасности | |
| Пиктограммы GHS |  |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Фталоцианин (H2Pc) представляет собой большое, ароматическое, макроциклическое, органическое соединение с формулой (C 8H4N2)4H2и представляет теоретический или специализированный интерес. Он состоит из четырех звеньев изоиндола, связанных атомами азота. H 2 Pc имеет двумерную геометрию и кольцевую систему, состоящую из 18 π-электронов. Обширная делокализация π-электронов придает молекуле полезные свойства, что позволяет находить применение в красителях и пигментах. Комплексы металлов, полученные из Pc., конъюгированного основания H 2 Pc, ценны в катализе, органических солнечных элементах, и фотодинамическая терапия.
 STM изображения отдельных молекул фталоцианина, записанные при смещении -2 В (слева) и +1 В (справа). Обратите внимание, что СТМ исследует плотность электронов в полосах HOMO / LUMO, а не в атомных профилях.
STM изображения отдельных молекул фталоцианина, записанные при смещении -2 В (слева) и +1 В (справа). Обратите внимание, что СТМ исследует плотность электронов в полосах HOMO / LUMO, а не в атомных профилях. Фталоцианин и производные комплексы металлов (MPc) имеют тенденцию к агрегированию и, таким образом, имеют низкую растворимость в обычных растворителях. 169>Бензол при 40 ° C растворяет менее миллиграмма H. 2Pc или CuPc на литр. H. 2Pc и CuPc легко растворяются в серной кислоте из-за протонирования атомов азота, соединяющих пиррольные кольца. Многие фталоцианиновые соединения термически очень стабильны и не плавятся, но могут быть сублимированы. CuPc сублимируется при температуре выше 500 ° C в инертных газах (азот, CO. 2 ). Замещенные фталоцианиновые комплексы часто имеют гораздо более высокую растворимость. Они менее термостойкие и часто не поддаются возгонке. Незамещенные фталоцианины сильно поглощают свет в диапазоне от 600 до 700 нм, поэтому эти материалы имеют синий или зеленый цвет. Замена может сдвинуть поглощение в сторону более длинных волн, изменяя цвет от чистого синего до зеленого и бесцветного (когда поглощение находится в ближнем инфракрасном диапазоне ).
Существует множество производных исходного фталоцианина, в которых либо атомы углерода макроцикла заменены на атомы азота, либо периферийные атомы водорода замещены функциональными группами, такими как галогены, гидроксил, амин, алкил, арил, тиол, алкокси и нитрозил группы. Эти модификации позволяют настраивать электрохимические свойства молекулы, такие как длины волн поглощения и излучения и проводимость.
В 1907 году было обнаружено неидентифицированное синее соединение, известное как фталоцианин. сообщил. В 1927 году швейцарские исследователи по счастливой случайности обнаружили фталоцианин меди, нафталоцианин меди и октаметилфталоцианин меди в попытке превратить о-дибромбензол в фталонитрил. Они отметили огромную стабильность этих комплексов, но не дали их дальнейшей характеристики. В том же году фталоцианин железа был обнаружен на предприятии Scottish Dyes в Grangemouth, Шотландия (позднее ICI ). Только в 1934 году сэр Патрик Линстед охарактеризовал химические и структурные свойства фталоцианина железа.
Фталоцианин образуется в результате циклотетрамеризации различных фталевых кислот. производные кислоты, включая фталонитрил, дииминоизоиндол, фталевый ангидрид и фталимиды. Альтернативно, нагревание фталевого ангидрида в присутствии мочевины дает H 2 Pc. С использованием таких способов в 1985 году было произведено приблизительно 57 000 тонн (63 000 тонн) различных фталоцианинов.

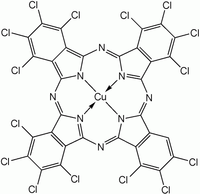
Чаще синтезируют MPc, а не H 2 Pc из-за большего интереса исследователей к первым. Для получения этих комплексов синтез фталоцианина проводят в присутствии солей металлов. Два фталоцианина меди показаны на рисунке ниже.
 |  |
Галогенированные и сульфированные производные фталоцианинов меди имеют коммерческое значение в качестве красителей. Такие соединения получают обработкой CuPc хлором, бромом или олеумом.
 Образец фталоцианина меди, демонстрирующий интенсивный цвет характеристика производных фталоцианина.
Образец фталоцианина меди, демонстрирующий интенсивный цвет характеристика производных фталоцианина. При первоначальном открытии Pc его использование в основном ограничивалось красителями и пигментами. Модификация заместителей, присоединенных к периферийным кольцам, позволяет регулировать абсорбционные и эмиссионные свойства Pc для получения красителей и пигментов различной окраски. С тех пор были проведены значительные исследования H 2 Pc и MPc, что привело к широкому спектру применений в областях, включая фотогальванику, фотодинамическую терапию, наночастицы строительство и катализ. Электрохимические свойства MPc делают их эффективными донорами и акцепторами электронов. В результате были разработаны органические солнечные элементы на основе MPc с эффективностью преобразования энергии не более 5%. Кроме того, MPc использовались в качестве катализаторов окисления метана, фенолов, спиртов, полисахаридов и олефинов; MPcs также могут использоваться для катализирования образования связи C – C и различных реакций восстановления. Фталоцианины кремния и цинка были разработаны в качестве фотосенсибилизаторов для неинвазивного лечения рака. Различные MPcs также продемонстрировали способность образовывать наноструктуры, которые могут иметь потенциальное применение в электронике и биосенсоре. Фталоцианин также используется на некоторых записываемых DVD.
Не поступало никаких свидетельств острой токсичности или канцерогенности фталоцианиновых соединений. LD50 (крысы, перорально) составляет 10 г / кг.
 Связь фталоцианина с порфириновым макроциклом. Две интрамакроциклические группы N-H опущены.
Связь фталоцианина с порфириновым макроциклом. Две интрамакроциклические группы N-H опущены. Фталоцианины структурно родственны другим тетрапиррольным макроциклам, включая порфирины и порфиразины. Они содержат четыре пиррольных -подобных субъединиц, связанных с образованием 16-членного внутреннего кольца, состоящего из чередующихся атомов углерода и азота. Структурно более крупные аналоги включают нафталоцианины. Пирролоподобные кольца в H. 2Pc тесно связаны с изоиндолом. И порфирины, и фталоцианины действуют как плоские тетрадентатные дианионные лиганды, которые связывают металлы через четыре выступающих внутрь азотных центра. Такие комплексы формально являются производными Pc., конъюгированного основания H. 2Pc.
| На Викискладе есть материалы, связанные с фталоцианинами. |