Внутреннее давление - это мера того, как внутренняя энергия системы изменяется при ее расширении или сжимается при постоянной температуре. Он имеет те же размеры, что и давление, единица СИ которого является паскаль.
Внутреннее давление обычно обозначается символом 
Внутреннее давление может быть выражено через температуру, давление и их взаимную зависимость:
Это уравнение является одним из простейших термодинамических уравнений. Точнее, это отношение термодинамических свойств, поскольку оно справедливо для любой системы и связывает уравнение состояния с одним или несколькими термодинамическими энергетическими свойствами. Здесь мы называем это «термодинамическим уравнением состояния».
| Вывод термодинамического уравнения состояния |
|---|
| В фундаментальном термодинамическом уравнении состояния для точного дифференциала внутренней энергии : Разделив это уравнение на И используя один из отношения Максвелла : |
В идеальном газе нет взаимодействия потенциальной энергии. между частицами, поэтому любое изменение внутренней энергии газа прямо пропорционально изменению кинетической энергии составляющих его частиц и, следовательно, также изменению температуры:

Внутреннее давление принимается при постоянной температуре, поэтому



т.е. внутренняя энергия идеального газа не зависит от объема, который он занимает. Приведенное выше соотношение можно использовать как определение идеального газа.
Отношение 

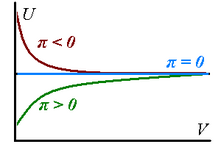 График зависимости внутренней энергии от. объем для газов с различным внутренним давлением
График зависимости внутренней энергии от. объем для газов с различным внутренним давлением Реальные газы имеют ненулевое внутреннее давление, потому что их внутренняя энергия изменяется по мере изотермического расширения газов - она может увеличиваться при расширении (

В пределе бесконечного объема эти внутренние давления достигают нулевое значение:

, что соответствует тому факту, что все реальные газы могут быть приближается к совершенству в пределах достаточно большого объема мне. Вышеупомянутые соображения резюмируются на графике справа.
Если реальный газ можно описать с помощью уравнения Ван-дер-Ваальса состояния
из термодинамического уравнения состояния следует, что
Поскольку параметр 
Кроме того, с помощью отношения цепочки Эйлера можно показать, что
Определение 


Коэффициент 

Джеймс Джоуль пытался измерить внутреннее давление воздуха в своем эксперименте с расширением с помощью адиабатической откачки воздуха под высоким давлением из одного металла. судно в другое эвакуированное. Водяная баня, в которую была погружена система, не изменила свою температуру, что означает отсутствие изменения внутренней энергии. Таким образом, внутреннее давление воздуха, очевидно, было равно нулю, и воздух действовал как идеальный газ. Фактических отклонений от идеального поведения не наблюдалось, поскольку они очень малы, а удельная теплоемкость для воды относительно высока.
Питер Аткинс и Хулио де Паула, Physical Chemistry 8th edition, pp. 60–61