Ингибиторы апоптоза - это группа белков, которые в основном действуют на внутренний путь, блокируя запрограммированную гибель клеток, что часто может приводить к раку или другие эффекты для клетки, если мутировала или неправильно регулируется. Многие из этих ингибиторов действуют, блокируя каспазы, семейство цистеиновых протеаз, которые играют неотъемлемую роль в апоптозе. Некоторые из этих ингибиторов включают семейство Bcl-2, вирусный ингибитор crmA и IAP.
Апоптоз, или запрограммированная гибель клеток, - это строго регулируемый процесс, используемый многими многоклеточными организмами. Как и любой регулируемый процесс, апоптоз может либо активироваться, либо подавляться множеством химических факторов. Апоптоз может быть вызван двумя основными путями; внешнее и внутреннее. Внешний путь в основном включает внеклеточные сигналы, запускающие механизмы внутриклеточного апоптоза путем связывания с рецепторами в клеточной мембране и посылки сигналов извне клетки. Внутренние пути вовлекают внутреннюю передачу сигналов клетки, главным образом, через митохондрии.
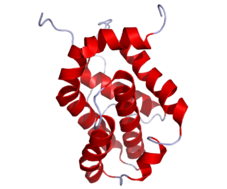 Кристаллическая структура Bcl-2 с видимыми доменами
Кристаллическая структура Bcl-2 с видимыми доменами Семейство белков Bcl-2 может либо ингибировать, либо способствовать апоптозу и члены характеризуются Bcl-2 гомологичными доменами BH1, BH2, BH3 и BH4. Комбинации доменов в белках определяют его роль в процессе апоптоза. Члены семейства, ингибирующие апоптоз, включают сам Bcl-2, Bcl-XL и Bcl-w, которые обладают всеми четырьмя доменами. Bcl-2 является наиболее известным из антиапоптотических членов и классифицируется как онкоген. Исследования показали, что онкоген Bcl-2 может ингибировать апоптоз двумя способами; либо непосредственно контролируя активацию каспаз, либо нарушая каналы, которые позволяют проапоптотическим факторам покидать митохондрии.
Что касается активации каспаз, в C. существует ген, называемый ced-9. elegans, который защищает от гибели клеток и является частью семейства Bcl-2. ced-9 кодирует белок, который структурно подобен Bcl-2, который связывается с другим белком ced-4, гомологом APAF-1 у человека, и не позволяет ему активировать каспазу ced-3, необходимый для уничтожения клетки. У людей APAF-1 фактически не взаимодействует с Bcl-2; скорее он активируется цитохромом с, высвобождение которого из митохондрий регулируется Bcl-2. BAX и BAK являются мультидоменными проапоптоическими членами семейства Bcl-2, которые лежат в цитозоле и митохондриях соответственно. После активации нескольких стимулов, приводящих к гибели клеток, BAX также перемещается в митохондрии, где выполняет там свои функции. Было обнаружено, что Bcl-2 и Bcl-xl секвестрируют молекулы домена BH3 в митохондриях, что предотвращает активацию BAX и BAK.
| Модификатор ответа цитокинов A | |||||||
|---|---|---|---|---|---|---|---|
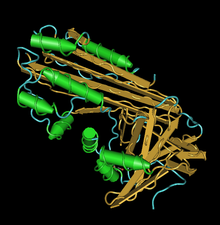 структура crmA с видимым доменом структура crmA с видимым доменом | |||||||
| Идентификаторы | |||||||
| Организм | Вирус коровьей оспы | ||||||
| Символ | CrmA | ||||||
| Альт. символы | Ингибитор сериновой протеиназы 2 | ||||||
| Entrez | 1486086 | ||||||
| RefSeq (Prot) | NP_619988.1 | ||||||
| UniProt | P07385 | ||||||
| Другие данные | |||||||
| Хромосома | геномный: 0,19 - 0,19 Mb | ||||||
| |||||||
crmA, или модификатор ответа цитокинов A, представляет собой коровью оспу серпин, который ингибирует каспазы 1, 6 и 8, образуя комплексы с этими каспазами, что делает их неспособными выполнять свои апоптотические функции. Коровья оспа - это вирус ортопоксии, который увеличивает их шансы на выживание и инфицирование за счет ингибирования конкретных каспаз и предотвращения воспалительных реакций и апоптоза.
Серпины обычно ингибируют сериновые протеазы с помощью механизма ингибирования суицидного субстрата, в котором серпин претерпевает резкое изменение структуры с образованием промежуточного ацильного фермента. Петля реактивного центра протеазы связана с центральной бета-петлей серпина, захватывая протеазу в состоянии, когда она больше не может выполнять свои каталитические функции. Исследования показали, что crmA использует метод, аналогичный серпиновому ингибированию сериновых протеаз, для ингибирования каспаз цистеиновых протеаз.
Ингибиторы белков апоптоза (IAP) представляют собой семейство функционально и структурно родственных белков, которые служат эндогенными ингибиторами запрограммированной гибели клеток (апоптоз ). Общей чертой всех IAP является присутствие BIR (Baculovirus IAP Repeat, домен из ~ 70 аминокислот) в одной-трех копиях. Семейство IAP человека состоит из 8 членов, и гомологи IAP были идентифицированы у многих организмов.
Первыми идентифицированными членами IAP были IAP бакуловируса, Cp-IAP и Op-IAP, которые связываются с каспазами и ингибируют их в качестве механизма, который способствует их эффективному инфицированию и репликации. цикл в хосте. Позже были обнаружены еще пять человеческих IAP, в том числе XIAP, cIAP1, C-IAP2, NAIP, Livin и Сурвивин.
. Лучше всего охарактеризован IAP XIAP, который связывает каспазу-9, каспазу-3 и каспазу-7., тем самым подавляя их активацию и предотвращая апоптоз. Также было показано, что cIAP1 и cIAP2 связывают каспазы, хотя то, как IAP механически ингибируют апоптоз на молекулярном уровне, полностью не изучено.
Активность XIAP блокируется связыванием с белками DIABLO (Smac) и HTRA2 (Omi), высвобождаемыми из митохондрий после проапоптотических стимулов.
Поскольку К середине 2000-х был достигнут значительный прогресс в разработке небольших молекул, имитирующих эндогенный лиганд IAP Smac. Один недавний пример, опубликованный в 2013 году, описывает синтез и тестирование пептидомиметиков, структура которых основана на связывающем мотиве IAP тетрапептида AVPI, присутствующем на N-конце зрелого Smac. Эти пептидомиметические соединения были особо отмечены за их исключительно высокий уровень связывания с Ливином, одним из важных членов семейства IAP, которому еще не уделялось много внимания с точки зрения открытия лекарств.
LCL161 - это лекарство, которое способствует гибели раковых клеток путем противодействие IAP. Клинические испытания продолжаются, но получили неоднозначную реакцию. В ходе клинических испытаний фазы I было установлено, что LCL161 хорошо переносится пациентами с развитыми солидными опухолями, хотя у них наблюдались рвота, тошнота, усталость и потеря аппетита. Другое исследование показало, что LCL161 снижает выживаемость и способствует эндотоксическому шоку при использовании в MYC-управляемой лимфоме. Другие клинические испытания все еще проводятся для определения эффективности лекарств.