 Образец потенциала замыкательной пластины (EPP; в среднем 10 отдельных EPP) показан вверху, а образцы потенциалов миниатюрной замыкательной пластины (mEPP) показаны внизу. Обратите внимание на различия в масштабах по осям X и Y. Оба взяты из записей нервно-мышечного соединения мыши.
Образец потенциала замыкательной пластины (EPP; в среднем 10 отдельных EPP) показан вверху, а образцы потенциалов миниатюрной замыкательной пластины (mEPP) показаны внизу. Обратите внимание на различия в масштабах по осям X и Y. Оба взяты из записей нервно-мышечного соединения мыши. Потенциалы концевой пластинки (EPPs ) - это напряжения, вызывающие деполяризацию волокон скелетных мышц, вызванную нейротрансмиттеры связываются с постсинаптической мембраной в нервно-мышечном соединении. Их называют «концевыми пластинами», потому что постсинаптические окончания мышечных волокон имеют большой, похожий на блюдце вид. Когда потенциал действия достигает конца аксона двигательного нейрона, везикулы, несущие нейротрансмиттеры (в основном ацетилхолин ), экзоцитозируются, и содержимое попадает в нервно-мышечный узел. Эти нейротрансмиттеры связываются с рецепторами постсинаптической мембраны и приводят к ее деполяризации. В отсутствие потенциала действия везикулы ацетилхолина спонтанно проникают в нервно-мышечные соединения и вызывают очень небольшие деполяризации в постсинаптической мембране. Этот небольшой ответ (~ 0,4 мВ) называется потенциалом миниатюрной концевой пластинки (MEPP) и генерируется одной везикулой, содержащей ацетилхолин. Он представляет собой наименьшую возможную деполяризацию, которая может быть вызвана в мышце.
 Передача сигнала от нерва к мышце на моторной концевой пластине.
Передача сигнала от нерва к мышце на моторной концевой пластине. Нервно-мышечное соединение - это синапс, который формируется между альфа-моторным нейроном (α-MN) и скелетной мышцей волокно. Чтобы мышца сокращалась, потенциал действия сначала передается по нерву, пока не достигнет конца аксона двигательного нейрона. Затем двигательный нейрон иннервирует мышечные волокна для сокращения, вызывая потенциал действия на постсинаптической мембране нервно-мышечного соединения.
Потенциалы концевой пластинки почти полностью вырабатываются нейромедиатором ацетилхолином в скелетных мышцах. Ацетилхолин является вторым по важности возбуждающим нейромедиатором в организме после глутамата. Он управляет соматосенсорной системой, которая включает в себя осязание, зрение и слух. Это был первый нейротрансмиттер, идентифицированный в 1914 году Генри Дейлом. Ацетилхолин синтезируется в цитоплазме нейрона из холина и ацетил-КоА. Холинацилтрансфераза - это фермент, который синтезирует ацетилхолин и часто используется в качестве маркера в исследованиях, связанных с производством ацетилхолина. Нейроны, которые используют ацетилхолин, называются холинергическими нейронами, и они очень важны для сокращения мышц, памяти и обучения.
Поляризация мембран контролируется натрием, калиевые, кальциевые и хлоридные ионные каналы. Существует два типа ионных каналов, участвующих в нервно-мышечном соединении и потенциалах концевой пластинки: потенциал-зависимый ионный канал и ионный канал, управляемый лигандом. Ионные каналы, управляемые напряжением, реагируют на изменения напряжения на мембране, которые вызывают открытие ионно-управляемых каналов и пропускают определенные ионы. Ионные каналы, управляемые лигандами, реагируют на определенные молекулы, такие как нейротрансмиттеры. Связывание лиганда с рецептором на белке ионного канала вызывает конформационное изменение, которое позволяет прохождение определенных ионов.
Обычно мембранный потенциал покоя моторного нейрона поддерживается на уровне от -70 мВ до -50 с более высокой концентрацией натрия снаружи и более высокой концентрацией калия внутри. Когда потенциал действия распространяется вниз по нерву и достигает конца аксона моторного нейрона, изменение мембранного напряжения заставляет кальциевые ионные каналы, управляемые напряжением, открываться, обеспечивая приток ионов кальция. Эти ионы кальция заставляют везикулы ацетилхолина, прикрепленные к пресинаптической мембране, высвобождать ацетилхолин посредством экзоцитоза в синаптическую щель.
EPP вызывается в основном связыванием ацетилхолина к рецепторам постсинаптической мембраны. Есть два разных типа рецепторов ацетилхолина: никотиновые и мускариновые. Никотиновые рецепторы представляют собой ионные каналы, управляемые лигандом, для быстрой передачи. Все рецепторы ацетилхолина в нервно-мышечном соединении никотиновые. Мускариновые рецепторы представляют собой рецепторы, связанные с G-белком, которые используют второй мессенджер. Эти рецепторы медленные и поэтому не могут измерить потенциал миниатюрной концевой пластинки (MEPP). Они расположены в парасимпатической нервной системе, например в блуждающем нерве и желудочно-кишечном тракте. Во время развития плода рецепторы ацетилхолина концентрируются на постсинаптической мембране, и вся поверхность нервного окончания у растущего эмбриона покрывается еще до того, как будет подан сигнал. Пять субъединиц, состоящих из четырех разных белков из четырех разных генов, составляют никотиновые ацетилхолиновые рецепторы, поэтому их упаковка и сборка - очень сложный процесс с множеством различных факторов. Фермент мышечно-специфическая киназа (MuSK) инициирует процессы передачи сигналов в развивающейся постсинаптической мышечной клетке. Он стабилизирует кластеры постсинаптических рецепторов ацетилхолина, способствует транскрипции синаптических генов ядрами мышечных волокон и запускает дифференцировку конуса роста аксона с образованием дифференцированного нервного окончания. Субстратный ламинин вызывает ускоренное созревание кластеров рецепторов ацетилхолина на поверхности мышечных трубок.
Все нейротрансмиттеры высвобождаются в синаптическую щель посредством экзоцитоза с синаптические пузырьки. Существуют два типа везикул нейромедиатора: большие плотные сердцевинные везикулы и маленькие прозрачные центральные везикулы. Большие плотные сердцевинные везикулы содержат нейропептиды и крупные нейротрансмиттеры, которые создаются в теле клетки нейрона и затем транспортируются через быстрый аксональный транспорт вниз к окончанию аксона. Небольшие прозрачные сердцевинные везикулы транспортируют мелкомолекулярные нейромедиаторы, которые локально синтезируются в пресинаптических окончаниях. Завершенные везикулы нейротрансмиттера связаны с пресинаптической мембраной. Когда потенциал действия распространяется вниз по аксону мотонейрона и достигает конца аксона, он вызывает деполяризацию конца аксона и открывает кальциевые каналы. Это вызывает высвобождение нейромедиаторов посредством экзоцитоза везикул.
После экзоцитоза везикулы повторно используются в процессе, известном как цикл синаптических везикул. Извлеченные везикулярные мембраны проходят через несколько внутриклеточных компартментов, где они модифицируются с образованием новых синаптических везикул. Затем они хранятся в резервном пуле до тех пор, пока они снова не понадобятся для транспортировки и высвобождения нейротрансмиттеров.
В отличие от резервного пула, легко высвобождаемый пул синаптических везикул готов к активации. Истощение везикул из легко высвобождаемого пула происходит во время длительной высокочастотной стимуляции, и размер вызванного EPP уменьшается. Эта нервно-мышечная депрессия возникает из-за меньшего высвобождения нейромедиаторов во время стимуляции. Чтобы не произошло истощения, должен существовать баланс между насыщением и истощением, что может происходить при низких частотах стимуляции менее 30 Гц.
Когда везикула высвобождает свои нейротрансмиттеры посредством экзоцитоза, она полностью опорожняет свое содержимое в синаптическую щель. Таким образом, высвобождение нейротрансмиттера из везикул считается количественным, поскольку может быть высвобождено только целое количество везикул. В 1970 г. Бернард Кац из Лондонского университета получил Нобелевскую премию по физиологии и медицине за статистическое определение количественного размера везикул ацетилхолина на основе анализа шума в нервно-мышечный переход. Используя книгу по механической статистике, он смог определить размер отдельных событий, происходящих в одно и то же время.
Синаптические везикулы ацетилхолина представляют собой синаптические везикулы с прозрачным ядром диаметром 30 нм. Каждая везикула ацетилхолина содержит приблизительно 5000 молекул ацетилхолина. Везикулы высвобождают все свое количество ацетилхолина, и это вызывает возникновение миниатюрных потенциалов концевой пластинки (MEPP), амплитуда которых меньше 1 мВ и недостаточна для достижения порогового значения.
Миниатюрные потенциалы концевой пластинки представляют собой небольшие (~ 0,4 мВ) деполяризации постсинаптического терминала, вызванные высвобождением единственного пузырька в синаптическую щель. Везикулы нейротрансмиттеров, содержащие ацетилхолин, спонтанно сталкиваются с нервным окончанием и высвобождают ацетилхолин в нервно-мышечное соединение даже без сигнала от аксона. Этих небольших деполяризаций недостаточно для достижения порога, и поэтому потенциал действия в постсинаптической мембране не возникает. Во время экспериментов с MEPPs было замечено, что часто возникают спонтанные потенциалы действия, называемые шипами концевой пластинки в нормальной поперечно-полосатой мышце без какого-либо стимула. Считалось, что эти шипы на концевой пластине возникли в результате повреждения или раздражения мышечных волокон из-за электродов. Недавние эксперименты показали, что эти шипы на концевой пластине на самом деле вызваны мышечными веретенами и имеют два разных образца: маленькие и большие. Маленькие шипы на концевой пластине имеют отрицательное начало без распространения сигнала, а большие шипы на концевой пластине напоминают потенциалы двигательных единиц (MUP). Мышечные веретена - это сенсорные рецепторы, которые измеряют удлинение или растяжение мышц и передают информацию в спинной или головной мозг для соответствующей реакции.
Когда действие Потенциал вызывает высвобождение многих везикул ацетилхолина, ацетилхолин диффундирует через нервно-мышечные соединения и связывается с лиганд-управляемыми никотиновыми рецепторами (неселективными катионными каналами) на мышечном волокне. Это позволяет увеличить поток ионов натрия и калия, вызывая деполяризацию сарколеммы (мембраны мышечной клетки). Небольшая деполяризация, связанная с высвобождением ацетилхолина из отдельного синаптического пузырька, называется потенциалом миниатюрной концевой пластинки (MEPP) и имеет величину около + 0,4 мВ. MEPP являются аддитивными, в конечном итоге увеличивая потенциал концевой пластинки (EPP) примерно с -100 мВ до порогового потенциала -60 мВ, при котором открываются потенциал-зависимые ионные каналы в постсинаптической мембране, позволяя внезапный поток ионов натрия из синапс и резкий всплеск деполяризации. Этот всплеск напряжения деполяризации запускает потенциал действия, который распространяется вниз по постсинаптической мембране, что приводит к сокращению мышц. Важно отметить, что ПОП - это не потенциалы действия, а то, что они запускают потенциалы действия. При нормальном мышечном сокращении высвобождается примерно 100-200 ацетилхолиновых везикул, вызывая деполяризацию, которая в 100 раз больше, чем MEPP. Это вызывает деполяризацию мембранного потенциала + 40 мВ (100 x 0,4 мВ = 40 мВ) от -100 мВ до -60 мВ, где он достигает порогового значения.
Когда мембранный потенциал достигает порогового значения, потенциал действия возникает и вызывает резкий всплеск полярности мембраны. Существует пять фаз потенциала действия: порог, деполяризация, пик, реполяризация и гиперполяризация.
Порог - это когда сумма MEPP достигает определенного потенциала и вызывает открытие потенциалзависимых ионных каналов. Быстрый приток ионов натрия заставляет мембранный потенциал достигать положительного заряда. Каналы ионов калия действуют медленнее, чем каналы ионов натрия, поэтому, когда мембранный потенциал начинает достигать пика, каналы ионов калия открываются и вызывают отток калия, чтобы противодействовать притоку натрия. На пике выход калия равен притоку натрия, и мембрана не меняет полярность.
Во время реполяризации натриевые каналы начинают инактивироваться, вызывая чистый отток ионов калия. Это вызывает падение мембранного потенциала до мембранного потенциала покоя -100 мВ. Гиперполяризация возникает из-за того, что медленно действующим калиевым каналам требуется больше времени для деактивации, поэтому мембрана превышает потенциал покоя. Он постепенно возвращается к потенциалу покоя и готов к проявлению другого потенциала действия.
Во время потенциала действия перед фазой гиперполяризации мембрана не реагирует на любую стимуляцию. Эта неспособность вызвать другой потенциал действия известна как период абсолютной рефрактерности. Во время периода гиперполяризации мембрана снова реагирует на стимуляцию, но для индукции потенциала действия требуется гораздо более высокая мощность. Эта фаза известна как относительный рефрактерный период.
После того, как потенциал действия в нервно-мышечном соединении исчерпан, использованный ацетилхолин выводится из синаптической щели ферментом ацетилхолинэстеразой. Некоторые заболевания и проблемы могут быть вызваны неспособностью ферментов удалить нейротрансмиттеры из синаптической щели, что ведет к продолжающемуся распространению потенциала действия.
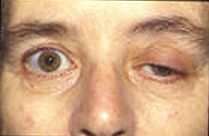 Пациент с миастенией гравис, демонстрирующий типичный симптом опускания век
Пациент с миастенией гравис, демонстрирующий типичный симптом опускания век Текущее исследование пытается узнать больше о потенциалах концевой пластинки и их влиянии на мышечную активность. Многие современные заболевания связаны с нарушением потенциальной активности замыкательной пластинки. У пациентов с болезнью Альцгеймера бета-амилоид присоединяется к рецепторам ацетилхолина и ингибирует связывание ацетилхолина. Это вызывает меньшее распространение сигнала и небольшие EPP, которые не достигают порога. Анализируя процессы в головном мозге с помощью ацетилхолина, врачи могут измерить количество бета-амилоида и использовать его для оценки его воздействия на болезнь Альцгеймера. Миастения - аутоиммунное заболевание, при котором организм вырабатывает антитела, нацеленные против рецептора ацетилхолина на постсинаптическая мембрана в нервно-мышечном соединении. Мышечная усталость и слабость, усиливающиеся при использовании и улучшающиеся после отдыха, являются отличительным признаком заболевания. Из-за ограниченного количества рецепторов ацетилхолина, которые доступны для связывания, симптоматическое лечение заключается в использовании ингибитора ацетилхолинэстеразы для уменьшения распада ацетилхолина в нервно-мышечном соединении, так что ацетилхолина будет присутствовать в достаточном количестве для небольшого количества неблокированных рецепторов. Врожденная аномалия, вызванная дефицитом ацетилхолинэстеразы концевой пластинки (AChE), может быть патофизиологическим механизмом миастенической гравис. В исследовании пациента с дефицитом AChE врачи отметили, что у него развилась серьезная слабость проксимальных и туловищных мышц с дрожанием других мышц. Было обнаружено, что сочетание дрожания и скорости блокирования рецепторов ацетилхолина вызывает снижение потенциала концевой пластинки, подобное тому, что наблюдается в случаях миастении. Исследование потенциалов двигательных единиц (MUP) привело к возможным клиническим применениям в оценке прогрессирования патологических заболеваний миогенного или нейрогенного происхождения путем измерения связанной константы нерегулярности. Потенциалы двигательных единиц - это электрические сигналы, производимые двигательными единицами, которые можно охарактеризовать амплитудой, длительностью, фазой и пиком, а коэффициент неравномерности (IR) рассчитывается на основе числа и амплитуд пиков. Миастенический синдром Ламберта-Итона представляет собой заболевание, при котором пресинаптические кальциевые каналы подвергаются аутоиммунному разрушению, которое вызывает экзоцитозирование меньшего числа везикул нейромедиаторов. Это вызывает меньшие EPP из-за того, что высвобождается меньше пузырьков. Часто более мелкие EPP не достигают порога, который вызывает мышечную слабость и утомляемость у пациентов. Многие животные используют нейротоксины, чтобы защитить себя и убить добычу. Тетродотоксин - яд, содержащийся в некоторых ядовитых рыбах, таких как иглобрюх и спинорогов, который блокирует каналы ионов натрия и предотвращает потенциал действия на постсинаптической мембране. Тетраэтиламмоний, обнаруженный у насекомых, блокирует калиевые каналы. Альфа-нейротоксин, обнаруженный у змей, связывается с рецепторами ацетилхолина и предотвращает связывание ацетилхолина. Альфа-латротоксин, обнаруженный у пауков «черная вдова», вызывает массовый приток кальция к окончанию аксона и приводит к переполнению выброса нейротрансмиттеров. Ботулинический токсин, продуцируемый бактериями Clostridium botulinum, является наиболее сильнодействующим токсичным белком. Он предотвращает высвобождение ацетилхолина в нервно-мышечном соединении, подавляя стыковку везикул нейромедиатора.