| биливердин редуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 1.3. 1.24 | ||||||||
| номер CAS | 9074-10-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| биливердинредуктазы A | |
|---|---|
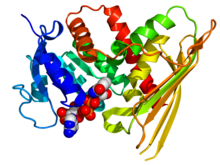 Кристаллографическая структура человеческой биливердинредуктазы A на основе PDB : 2H63 координаты. Фермент отображается в виде рисунка цвета радуги (N-конец = синий, C-конец = красный), а кофактор NADP отображается как модель заполнения пространства (углерод = белый, кислород = красный, азот = синий, фосфор = оранжевый). Кристаллографическая структура человеческой биливердинредуктазы A на основе PDB : 2H63 координаты. Фермент отображается в виде рисунка цвета радуги (N-конец = синий, C-конец = красный), а кофактор NADP отображается как модель заполнения пространства (углерод = белый, кислород = красный, азот = синий, фосфор = оранжевый). | |
| Идентификаторы | |
| Символ | BLVRA |
| Альт. символы | BLVR |
| ген NCBI | 644 |
| HGNC | 1062 |
| OMIM | 109750 |
| RefSeq | NM_000712 |
| UniProt | P53004 |
| Прочие данные | |
| Номер ЕС | 1.3.1.24 |
| Locus | Chr. 7 p14-cen |
| биливердин редуктаза B | |
|---|---|
| Идентификаторы | |
| Символ | BLVRB |
| Альт. символы | FLR |
| Ген NCBI | 645 |
| HGNC | 1063 |
| OMIM | 600941 |
| RefSeq | NM_000713 |
| UniProt | P30043 |
| Прочие данные | |
| Номер ЕС | 1.3.1.24 |
| Locus | Chr. 19 q13.1-13.2 |
| Биливердинредуктаза, каталитическая | |||||||||
|---|---|---|---|---|---|---|---|---|---|
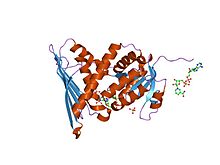 кристаллическая структура комплекса фермент-кофактор биливердинредуктазы кристаллическая структура комплекса фермент-кофактор биливердинредуктазы | |||||||||
| Идентификаторы | |||||||||
| Символ | Biliv-reduc_cat | ||||||||
| Pfam | PF09166 | ||||||||
| InterPro | IPR015249 | ||||||||
| SCOPe | 1lc0 / SUPFAM | ||||||||
| |||||||||
Биливердинредуктаза (BVR ) - фермент (EC 1.3.1.24 ), обнаруженный во всех тканях в нормальных условиях, но особенно в ретикуло-макрофагах печени и селезенки. BVR способствует превращению биливердина в билирубина посредством восстановления двойной связи между вторым и третьим пиррольным кольцом в одиночное -облигация.
Существует два изофермента у человека, каждый из которых кодируется собственным геном: биливердинредуктаза A (BLVRA) и биливердинредуктаза B ( BLVRB).
BVR действует на биливердин, восстанавливая его двойную связь между пиррольными кольцами до одинарной связи. Это достигается с помощью НАДФН + Н в качестве донора электронов, образуя билирубин и НАДФ в качестве продуктов.
BVR катализирует эту реакцию через перекрывающийся сайт связывания, включая Lys, Lys, Lys, Arg и Arg в качестве ключевых остатков. Этот сайт связывания прикрепляется к биливердину и вызывает его диссоциацию от гемоксигеназы (HO) (которая катализирует реакцию гема трехвалентного железа ->биливердина ), вызывая последующее восстановление до билирубина.
 Восстановление биливердина до билирубин, катализируемый биливердинредуктазой. Восстановление биливердина до билирубин, катализируемый биливердинредуктазой. |
BVR состоит из двух тесно упакованных доменов длиной 247-415 аминокислот, содержащих складку Россмана. Также было определено, что BVR является цинк-связывающим белком, причем каждый ферментный белок имеет один сильно связывающийся атом цинка.
C-концевая половина BVR содержит каталитический домен, который принимает структуру , содержащую шестицепочечный бета-лист, который фланкирован с одной стороны несколькими альфа-спиралями. Этот домен содержит каталитический активный сайт, который восстанавливает гамма-метеновый мостик открытого тетрапиррола, биливердина IX альфа, до билирубина с сопутствующим окисление кофактора NADH или NADPH .
BVR работает с окислительно-восстановительным циклом биливердин / билирубин. Он превращает биливердин в билирубин (сильный антиоксидант), который затем превращается обратно в биливердин под действием активных форм кислорода (ROS). Этот цикл позволяет нейтрализовать АФК и повторно использовать продукты биливердина. Биливердин также пополняется в цикле за счет его образования из гемовых звеньев через гемоксигеназу (HO), локализованную в эндоплазматическом ретикулуме.
Билирубин, являющийся одним из последних продуктов гема распад в печени, далее обрабатывается и выводится с желчью после конъюгации с глюкуроновой кислотой. Таким образом, BVR важен для многих млекопитающих для удаления катаболитов гема - особенно у плода, где плацентарные мембраны проницаемы для билирубина, но не проницаемы для биливердина, что способствует удалению накопления потенциально токсичного белка.
BVR также недавно был признан регулятором метаболизма глюкозы, а также контроля роста клеток и апоптоза благодаря его киназному характеру двойной специфичности. Этот контроль метаболизма глюкозы указывает на то, что BVR может играть роль в патогенезе множества метаболических заболеваний, наиболее заметным из которых является диабет за счет контроля вышестоящего активатора фактора роста инсулина-1 (IGF-1) и сигнальный путь митоген-активируемой протеинкиназы (MAPK).
BVR действует как средство для регенерации билирубина в повторяющемся окислительно-восстановительном цикле без значительного изменения концентрации доступного билирубина. При сохранении этих уровней кажется, что BVR представляет собой новую стратегию лечения рассеянного склероза и других типов заболеваний, опосредованных окислительным стрессом. Этот механизм обусловлен усилением мощного антиоксидантного действия билирубина, так как это может облегчить заболевания, опосредованные свободными радикалами.
Исследования показали, что окислительно-восстановительный цикл BVR необходим для обеспечения физиологической цитопротекции. Генетические нокауты и снижение уровней BVR продемонстрировали повышенное образование ROS и приводят к усиленной гибели клеток. Клетки, у которых наблюдалось снижение BVR на 90%, имели в три раза больше нормальных уровней ROS. Посредством этого защитного и усиливающего цикла BVR позволяет низким концентрациям билирубина преодолевать в 10000 раз более высокие концентрации ROS.