 | |
 | |
| Имена | |
|---|---|
| ИЮПАК 3,4-дигидро-2Н-нафталин-1-он | |
| Другие имена α-тетралон; 1-Tetralone | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.007.692 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | C10H10O |
| Молярный масса | 146,189 г · моль |
| Внешний вид | бесцветная жидкость |
| Плотность | * 1,099 г · см (25 °C ) |
| Точка плавления | 2–7 ° C |
| Точка кипения | * 255–257 ° C
|
| Растворимость в воде | нерастворимый |
| Растворимый | растворимый в органических растворителях |
| Давление пара | 2,7 Па (20 ° C) |
| Показатель преломления (nD) | 1,5672 |
| Если не указано иное, данные приведены для материалов в eir стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки ink | |
1-Tetralone представляет собой бициклический ароматический углеводород и кетон. По своей структуре его также можно рассматривать как бензоконденсированный циклогексанон. Это бесцветное масло со слабым запахом. Он используется в качестве исходного материала для сельскохозяйственных и фармацевтических средств. углеродный скелет 1-тетралона обнаружен в натуральных продуктах, таких как аристелегон A (4,7-диметил-6-метокси-1-тетралон) из семейства Aristolochiaceae используется в традиционной китайской медицине.
Как уже было описано в 1933 г. Генрих Хок, 1,2,3,4-тетрагидронафталин имеет тенденцию самоокисляться и постепенно образует 1-гидропероксид с кислородом воздуха. Катализируемое ионами тяжелых металлов окисление 1,2,3,4-тетрагидронафталина на воздухе с помощью Cr или Cu в жидкой фазе приводит через гидропероксид к смеси промежуточного 1-тетралола и конечного продукта 1-тетралона.

точки кипения основного компонента 1-тетралона (255-257 ° C) и второстепенного компонента 1-тетралола (255 ° C) практически идентичны, поэтому последний удаляется химической реакцией.
Исходное соединение 4-фенилбутановая кислота (натриевая соль которой фенилбутират натрия используется для лечения гипераммонемии ) доступно из 3-бензоилпропановой кислоты посредством каталитического гидрирования с использованием палладиевого контактного катализатора. Сама 3-бензоилпропановая кислота может быть получена по реакции Хаворта (вариант реакции Фриделя-Крафтса ) из бензола и янтарного ангидрида.
Внутримолекулярная циклизация 4-фенилбутановой кислоты до 1-тетралона катализируется полифосфорной кислотой и метансульфоновой кислотой.

Это было описано как обучающий эксперимент для уроков химии. 4-Фенилбутановая кислота также может быть количественно превращена в 1-тетралон нагреванием в присутствии сильного катализатора на основе кислоты Льюиса , такого как бис (трифторметансульфонил) амид висмута (III) [Bi (NTf 2)3], который относительно легко доступен.
Использование хлорангидрида и хлорида олова (IV) (SnCl 4) позволяет значительно сократить время реакции раз, чем ацилирование Фриделя-Крафтса 4-фенилбутановой кислотой.

Хлориды 4-фенилбутановой кислоты с электронодонорными группами могут быть циклизованы до 1-тетралонов в мягких условиях реакции с выходами более 90%, используя сильные водородные связи растворитель гексафторизопропанол (HFIP).
Катализируемое AlCl 3 ацилирование бензола γ-бутиролактоном дает 1- тетралон.

1-тетралон может быть снижен посредством восстановления по Березе с помощью лития в жидком аммиаке до 1,2, 3,4-тетрагидронафталин. Кетогруппа также может быть преобразованный во вторичный спирт с образованием 1-тетралола, когда применяется модифицированный процесс, с использованием добавления водного раствора хлорида аммония после выпаривания аммиака.

С кальцием в жидком аммиаке 1-тетралон является восстанавливается до 1-тетралола при -33 ° C с выходом 81%.
Метиленовая группа в α-положении по отношению к кетогруппе особенно реакционноспособна и может быть преобразована с формальдегидом (в форме тримерного триоксан ) в 2-метилен-1-тетралон в присутствии соли трифторуксусной кислоты и N-метиланилина с выходами до 91%.

2-метиленкетон стабилен при температурах ниже -5 ° C, но полностью полимеризуется при комнатной температуре в течение 12 часов.
В реакции Пфитцингера 1-тетралона с изатином образуется соединение, называемое тетрофаном (3,4-дигидро-1,2-бензакридин-5-карбоновая кислота).

Реакционная способность α-метиленовой группы равна также используется в реакции 1-тетралона с метанолом при 270-290 ° C, которая образуется посредством дегидрирования и образования ароматической нафталиновой кольцевой системы 2-метил-1-нафтола с выходом 66%.

оксим 1-тетралона реагирует с уксусным ангидридом, что приводит к ароматизации циклоалканонового кольца. Полученный N- (1-нафтил) ацетамид имеет биологические свойства, аналогичные свойствам 2- (1-нафтил) уксусной кислоты в качестве синтетического ауксина.
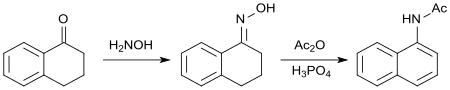
. Третичный спирт, образующийся в Реакция Гриньяра 1-тетралона с фенилмагнийбромидом взаимодействует с уксусным ангидридом при отщеплении воды до 1-фенил-3,4-дигидронафталина, который дегидратируется элементарным сера с общим выходом примерно 45% до.

Катализируемое рутением (II) арилирование 1-тетралона с использованием неопентилгликолевого эфира фенилбороновой кислоты дает 8-фенил-1 -тетралон с выходом до 86%.

С 5-аминотетразолом и ароматическим альдегидом 1-тетралон реагирует в многокомпонентной реакции при микроволновом облучении с образованием четырех -членная гетероциклическая кольцевая система.

Безусловно, наиболее важным применением 1-тетралона является синтез 1-нафтола путем ароматизации, например при контакте с платиновыми катализаторами при температуре от 200 до 450 ° C.
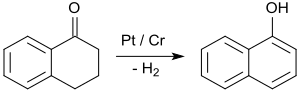
1-нафтол является исходным материалом для инсектицидов карбарила и бета-блокаторов пропранолол.
Токсикологические исследования были проведены на кроликах с LD50 2192 мг / кг массы тела.