| Заместитель | Es | σ * |
|---|---|---|
| –H | 1,24 | 0,49 |
| –CH3 | 0 | 0 |
| –CH2CH3 | –0,07 | –0,1 |
| –CH(CH3)2 | –0,47 | –0,19 |
| –C(CH3)3 | –1,54 | –0,3 |
| –CH2Ph | –0,38 | 0,22 |
| –Ph | –2,55 | 0,6 |
Уравнение Тафта представляет собой линейную зависимость свободной энергии (LFER), используемую в физической органической химии при исследовании механизмы реакции и в разработке количественных соотношений структура – активность для органических соединений. Он был разработан в 1952 году как модификация уравнения Хамметта. В то время как уравнение Хаммета объясняет, как эффекты индукции и резонанса влияют на скорость реакции, уравнение Тафта также описывает стерические эффекты заместителя . Уравнение Тафта записывается как:

где 
Полярные константы заместителей описывают то, как заместитель будет влиять на реакцию посредством полярных (индуктивных, полевых и резонансных) эффектов. Для определения σ Taft изучал гидролиз метил сложных эфиров (RCOOMe). Использование скоростей гидролиза сложного эфира для изучения полярных эффектов было впервые предложено Инголдом в 1930 году. Гидролиз сложных эфиров может происходить посредством механизмов, катализируемых кислотой или основанием, оба из которых протекают через тетраэдр средний. В механизме, катализируемом основанием, реагент переходит от нейтральных частиц к отрицательно заряженному промежуточному продукту на стадии , определяющей скорость (медленной) стадии, в то время как в механизме, катализируемом кислотой, положительно заряженный реагент переходит в положительно заряженный промежуточный продукт.
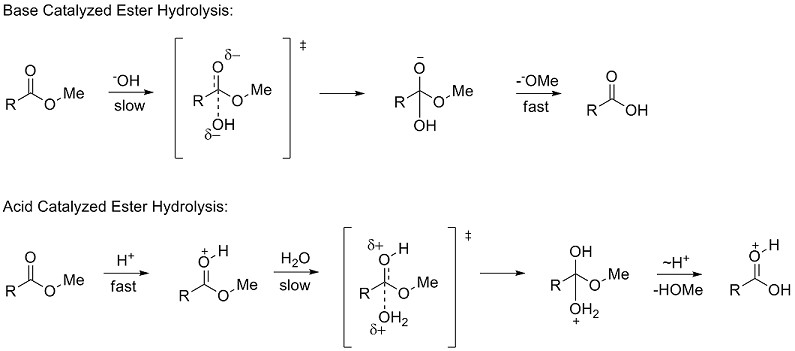
Из-за сходных тетраэдрических промежуточных соединений Тафт предположил, что при идентичных условиях любые стерические факторы должны быть почти одинаковыми для двух механизмов и, следовательно, не будут влиять на соотношение скоростей. Однако из-за разницы в накоплении заряда на этапах определения скорости было предположено, что полярные эффекты будут влиять только на скорость реакции, катализируемой основанием, поскольку образуется новый заряд. Он определил константу полярного заместителя σ * как:
![{\ displaystyle \ sigma ^ {*} = \ left ({\ frac {1} {2.48 \ rho ^ {*}}} \ right) {\ Bigg [} \ log \ left ({\ frac {k_ {s}} {k _ {{\ ce {CH3}}}}} \ right) _ {B} - \ log \ left ({\ frac { k_ {s}} {k _ {{\ ce {CH3}}}}} \ right) _ {A} {\ Bigg]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ea2670a97aa75d22723d4617539ca85ee094bf9)
где log (k s/kCH3)B- отношение скорости реакции, катализируемой основанием, по сравнению с эталонной реакцией, log (k s/kCH3)A- отношение скорости реакции, катализируемой кислотой, по сравнению с эталонной реакцией). реакции, а ρ * - константа реакции, которая описывает чувствительность серии реакций. Для определения серии реакций ρ * было установлено равным 1, а R = метил был определен как эталонная реакция (σ * = ноль). 1 / 2,48 включено, чтобы сделать σ * близким по величине к значениям σ Хаммета.
Хотя катализируемый кислотой и катализируемый основанием гидролиз сложных эфиров дает переходные состояния для шагов определения скорости th при разной плотности заряда их структуры различаются только двумя атомами водорода. Таким образом, Тафт предположил, что стерические эффекты будут одинаково влиять на оба механизма реакции. Вследствие этого стерическая константа заместителя E s определялась исключительно по реакции, катализируемой кислотой, поскольку она не должна включать полярные эффекты. E s был определен как:

где k s - скорость исследуемой реакции, а 
Из сравнения значений E s для метила, этила, изопропил и трет-бутила, это Видно, что значение увеличивается с увеличением стерического объема. Однако, поскольку контекст будет влиять на стерические взаимодействия, некоторые значения E s могут быть больше или меньше ожидаемых. Например, значение для фенила намного больше, чем для трет-бутила. При сравнении этих групп с использованием другой меры стерического объема, значений осевой деформации, трет-бутильная группа больше.
В дополнение к Тафту. стерический параметр E s, были определены другие стерические параметры, которые не зависят от кинетических данных. Чартон определил значения v, которые получены из радиусов Ван-дер-Ваальса. Используя молекулярную механику, Мейерс определил значения V, которые получены из объема части заместителя, находящейся в пределах 0,3 нм от реакционного центра.
Подобно значениям ρ для графиков Хаммета, коэффициент полярной чувствительности ρ * для графиков Тафта будет описывать восприимчивость серии реакций к полярным эффектам. Когда стерические эффекты заместителей существенно не влияют на скорость реакции, уравнение Тафта упрощается до формы уравнения Хамметта:

Коэффициент полярной чувствительности ρ * может быть получен следующим образом: построение отношения измеренных скоростей реакции (k s) по сравнению с эталонной реакцией (
Подобно коэффициенту полярной чувствительности, коэффициент стерической чувствительности δ для новой серии реакций будет описывать, до какой степени на скорость реакции влияют стерические эффекты. Когда полярные эффекты не оказывают значительного влияния на серию реакций, уравнение Тафта сводится к:

График отношения скоростей к значению E s для заместителя даст прямая с наклоном, равным δ. Подобно значению Hammett ρ, величина δ будет отражать степень влияния стерических эффектов на реакцию:
Поскольку значения E s большие и отрицательные для более объемных заместителей, следует, что:
Когда и стерические, и полярные эффекты влияют на скорость реакции. Уравнение Тафта может быть решено как для ρ *, так и для δ с использованием стандартных методов наименьших квадратов для определения a. Тафт описал применение этого метода для решения уравнения Тафта в статье 1957 года.
Уравнение Тафта часто используется в биологической химии и медицинская химия для разработки количественных соотношений структура – активность (QSAR). В недавнем примере Сандри и соавторы использовали графики Тафта в исследованиях полярных эффектов в аминолизе β-лактамов. Они изучили связывание β-лактамов с поли (этиленимин) полимером, который функционирует как простой имитатор человеческого сывороточного альбумина (HSA). Считается, что образование ковалентной связи между пенициллинами и HSA в результате аминолиза остатками лизина связано с аллергией на пенициллин. В рамках своих механистических исследований Сандри и его сотрудники построили график скорости аминолиза в сравнении с рассчитанными значениями σ * для 6 пенициллинов и не обнаружили корреляции, предполагая, что на скорость влияют другие эффекты в дополнение к полярным и стерическим эффектам.