 | |
| Клинические данные | |
|---|---|
| Другие названия | (6R, 8S, 10R, 12S) -7,15- диазатетрацикло [7.7.1.0.0] гептадекан |
| AHFS / Drugs.com | Международные названия лекарственных средств |
| Код ATC | |
Название IUPAC
| |
| Номер CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL |
|
| Dashboard>CompT>(EPA ) | |
| ECHA InfoCard | 100.001.808 |
| Химические и физические данные | |
| Формула | C15H26N2 |
| Молярная масса | 234,387 г · моль |
| 3D-модель ( JSmol ) | |
| Плотность | 1,02 г / см |
| Температура плавления | 30 ° C (86 ° F) |
| Температура кипения | 325 ° C (617 ° F) |
| Растворимость в воде | 3,04 мг / мл (20 ° C) |
УЛЫБКИ
| |
InChI
| |
| (что это?) | |
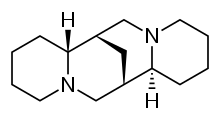
Спартеин относится к классу 1a антиаритмических средств ; блокатор натриевых каналов. Это алкалоид, его можно извлечь из веника. Он является преобладающим алкалоидом в Lupinus mutabilis и, как полагают, хелатирует двухвалентные катионы кальция и магния. Он не одобрен FDA для использования человеком в качестве антиаритмического средства и не включен в классификацию антиаритмических препаратов Вогана Вильямса.
Он также используется в качестве хирального лиганда в органической химии, особенно в синтезе с использованием литийорганических реагентов.
 Первоначально предложенный путь биосинтеза спартеина
Первоначально предложенный путь биосинтеза спартеина Спартеин представляет собой люпин алкалоид, содержащий тетрациклическую бис-хинолизидиновую кольцевую систему, полученную из трех C 5 цепей лизина или, более конкретно, L-лизина. Первым промежуточным продуктом в биосинтезе является кадаверин, продукт декарбоксилирования лизина, катализируемый ферментом лизиндекарбоксилазой (LDC). Три единицы кадаверина используются для формирования хинолизидинового скелета. Механизм образования был изучен ферментативно, а также с помощью экспериментов с индикаторами, но точный путь синтеза все еще остается неясным.
Изучение индикаторов с использованием кадаверина с двойной меткой C-N показало, что три единицы кадаверина включены в спартеин и две из C-N-связи двух единиц кадаверина остаются нетронутыми. Наблюдения также были подтверждены с помощью экспериментов по мечению H ЯМР.
Ферментативные данные затем показали, что три молекулы кадаверина трансформируются в хинолизидиновое кольцо через промежуточные соединения, связанные с ферментом, без образования каких-либо свободных промежуточных соединений. Первоначально считалось, что превращение кадаверина в соответствующий альдегид, 5-аминопентаналь, катализируется ферментом диаминоксидазой. Затем альдегид самопроизвольно превращается в соответствующее основание Шиффа, Δ-пиперидин. Сцепление двух молекул происходит между двумя таутомерами Δ-пиперидина в реакции альдольного типа. Затем имин гидролизуют до соответствующего альдегида / амина. Затем первичный амин окисляется до альдегида с последующим образованием имина с образованием хинолизидинового кольца.
Более недавние ферментативные данные указывают на присутствие (OS), фермент трансаминаза. Дезаминированный кадаверин не высвобождается из фермента, поэтому можно предположить, что фермент катализирует образование хинолизидинового скелета каналированным образом. 7-оксоспартеину требуется четыре единицы пирувата в качестве акцепторов NH 2, и он дает четыре молекулы аланина. И лизиндекарбоксилаза, и хинолизидиновый скелетообразующий фермент локализованы в хлоропластах.
Биосинтез спартеина 17-оксоспартеинсинтазой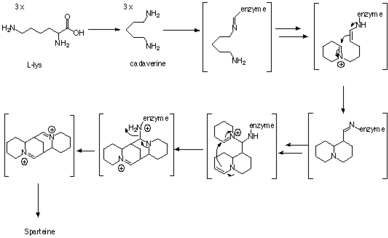 Предлагаемые этапы циклизации кольца
Предлагаемые этапы циклизации кольца  Общая схема
Общая схема | title =()| Wikisource содержит текст статьи 1905 года Новой международной энциклопедии «Спартеин ". |