В спектроскопии и химии квантовой, то кратность из уровня энергии определяется как 2S + 1, где S представляет собой суммарный спиновый момент. Состояния с кратностью 1, 2, 3, 4, 5 соответственно называются синглетами, дублетами, триплетами, квартетами и квинтетами.
В основном состоянии атома или молекулы все неспаренные электроны обычно имеют параллельный спин. В этом случае множественность также равна числу неспаренных электронов плюс один.
Множественность часто равна количеству возможных ориентаций полного спина относительно полного орбитального углового момента L и, следовательно, количеству почти вырожденных уровней, которые различаются только своей энергией спин-орбитального взаимодействия.
Например, основное состояние углерода атома представляет собой 3 Р - состояние. Верхний индекс три (читается как триплет ) указывает, что кратность 2S + 1 = 3, так что полный спин S = 1. Этот спин обусловлен двумя неспаренными электронами в результате правила Хунда, которое способствует однократному заполнению вырожденных орбиталей.. Триплет состоит из трех состояний со спиновыми компонентами +1, 0 и –1 вдоль направления полного орбитального углового момента, который также равен 1, как обозначено буквой P. Квантовое число полного углового момента J может изменяться от L + S = 2 до L – S = 0 с шагом целого числа, так что J = 2, 1 или 0.
Однако множественность равна количеству ориентаций спина, только если S ≤ L. Когда Sgt; L, возможны только 2L + 1 ориентации полного углового момента в диапазоне от S + L до SL. Основным состоянием атома азота является состояние 4 S, для которого 2S + 1 = 4 в квартетном состоянии, S = 3/2 из-за трех неспаренных электронов. Для состояния S L = 0, так что J может быть только 3/2, и есть только один уровень, даже если кратность равна 4.
Большинство стабильных органических молекул имеют полные электронные оболочки без неспаренных электронов и, следовательно, имеют синглетные основные состояния. Это верно также для неорганических молекул, содержащих только элементы основной группы. Важными исключениями являются дикислород (O 2), а также метилен (CH 2) и другие карбены.
Однако, более высокие спина основные состояния очень распространены в координационных комплексов с переходными металлами. Простое объяснение спиновых состояний таких комплексов дает теория кристаллического поля.
Самый высокий занятый орбитальный энергетический уровень дикислорода - это пара разрыхляющих π * -орбиталей. В основном состоянии дикислорода этот энергетический уровень занят двумя электронами с одинаковым спином, как показано на диаграмме молекулярных орбиталей. Таким образом, молекула имеет два неспаренных электрона и находится в триплетном состоянии.
Напротив, первое и второе возбужденные состояния дикислорода являются состояниями синглетного кислорода. Каждый из них имеет два электрона с противоположным спином на уровне π *, так что S = 0 и, следовательно, множественность равна 2S + 1 = 1.
В первом возбужденном состоянии два π * -электрона спарены на одной орбитали, так что неспаренных электронов нет. Однако во втором возбужденном состоянии два π * -электрона занимают разные орбитали с противоположным спином. Таким образом, каждый из них является неспаренным электроном, но полный спин равен нулю, а множественность равна 2S + 1 = 1, несмотря на наличие двух неспаренных электронов. Следовательно, кратность второго возбужденного состояния не равна числу его неспаренных электронов плюс один, и правило, которое обычно верно для основных состояний, не действует для этого возбужденного состояния.
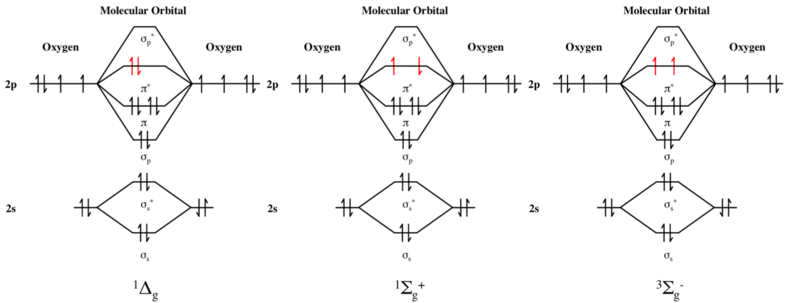 Молекулярная орбитальная диаграмма двух синглетных возбужденных состояний и триплетного основного состояния O 2. Слева направо диаграммы для: 1 Δ g синглетного кислорода (первое возбужденное состояние), 1 Σ+ гсинглетный кислород (второе возбужденное состояние) и 3 Σ- г триплетный кислород (основное состояние).
Молекулярная орбитальная диаграмма двух синглетных возбужденных состояний и триплетного основного состояния O 2. Слева направо диаграммы для: 1 Δ g синглетного кислорода (первое возбужденное состояние), 1 Σ+ гсинглетный кислород (второе возбужденное состояние) и 3 Σ- г триплетный кислород (основное состояние). В области органической химии, карбены представляют собой молекулы, имеющие атомы углерода с только шесть валентных электронов и, следовательно, не подчиняться правилу октета. Карбены обычно разделяются на синглетные карбены и триплетные карбены, названные в честь их спиновой множественности. Оба имеют два несвязывающих электрона; в синглетных карбенах они существуют как неподеленная пара и имеют противоположные спины, так что нет чистого спина, тогда как в триплетных карбенах эти электроны имеют параллельные спины.