 . β-Ga 2O3кристалл . β-Ga 2O3кристалл | |
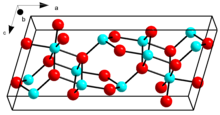 . Кристаллическая структура β-Ga 2O3 . Кристаллическая структура β-Ga 2O3 | |
| Имена | |
|---|---|
| Другие названия триоксид галлия, полуторный диоксид галлия | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.031.525 |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | Ga2O3 |
| Молярная масса | 187,444 г / моль |
| Внешний вид | белый кристаллический порошок |
| Плотность | 6,44 г / см, альфа. 5,88 г / см, бета |
| точка плавления | 1900 ° C (3450 ° F; 2170 K) альфа. 1725 ° C, бета |
| Растворимость в воде | нерастворим |
| Растворимость | растворим в большинство кислот |
| Структура | |
| Кристаллическая структура | α: Тригональная, hR30, пространственная группа = R3c, No. 167. β: Моноклинический, mS20, пространственная группа = C2 / m, № 12 |
| Постоянная решетки | a = 0,49835 / 1,22247 нм, b = 0,49835 / 0,30403 нм, c = 0,53286 / 0,58088 нм |
| Формульные единицы (Z) | 6/4 |
| Термохимия | |
| Теплоемкость (C) | 92,1 Дж / моль · K |
| Стандартная молярная. энтропия (S 298) | 85,0 Дж / моль · K |
| Стандартная энтальпия образования. (ΔfH298) | −1089,1 кДж / моль |
| свободная энергия Гиббса (ΔfG˚) | -998,3 кДж / моль |
| Опасности | |
| Классификация ЕС (DSD) (устарело) | не указан |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Триоксид галлия (III) представляет собой неорганическое соединение с формулой Ga2 O3. Он существует в виде нескольких полиморфов, все из которых представляют собой белые нерастворимые в воде твердые вещества. Хотя коммерческого применения не существует, Ga 2O3является промежуточным продуктом при очистке галлия, который потребляется почти исключительно в виде арсенида галлия. Теплопроводность β-Ga 2O3по крайней мере на порядок ниже, чем у других полупроводников с широкой запрещенной зоной, таких как GaN и SiC. Он дополнительно уменьшается для родственных наноструктур, которые обычно используются в электронных устройствах. Гетерогенная интеграция с подложками с высокой теплопроводностью, такими как алмаз и SiC, способствует рассеиванию тепла электроники β-Ga 2O3.
Триоксид галлия осаждают в гидратированной форме при нейтрализации кислого или основного раствора соли галлия. Также он образуется при нагревании галлия на воздухе или при термическом разложении нитрата галлия при 200–250 ˚C. Он может иметь пять различных модификаций: α, β, γ, δ и ε. Из этих модификаций β-Ga 2O3является наиболее стабильной формой.
Триоксид галлия (III) амфотерный. Он реагирует с щелочным металлом оксиды при высокой температуре с образованием, например, NaGaO 2, и с оксидами Mg, Zn, Co, Ni, Cu с образованием шпинелей, например MgGa 2O4. растворяется в сильной щелочи с образованием раствора галлат-иона Ga (OH). 4.
С HCl образует трихлорид галлия GaCl 3.
Он может быть восстановлен до субоксида галлия (оксида галлия (I)) Ga 2 O с помощью H 2. Или реакцией с галлием металл:
β-Ga 2O3с температурой плавления 1900 ° C является наиболее стабильной кристаллической модификацией. Ионы оксида находятся в искаженной кубической структуре плотнейшей упаковки, а ионы галлия (III) занимают искаженные тетраэдрические и октаэдрические позиции с расстояниями связей Ga-O 1,83 и 2,00 Å соответственно.
α-Ga 2O3имеет ту же структуру (корунд ), что и α-Al 2O3, в котором ионы Ga являются 6-координатными. γ-Ga 2O3имеет дефектную структуру шпинели, аналогичную структуре пленок γ-Al 2O3.
ε-Ga 2O3, осажденных методом металлоорганической газофазной эпитаксии. показывает столбчатую структуру с ромбическая симметрия кристалла. Макроскопически эта структура определяется рентгеновской кристаллографией как гексагональная плотноупакованная.
Оксид галлия (III) был изучен с использованием лазеров, люминофоров., и люминесцентные материалы. Он также использовался в качестве изолирующего барьера в плотных соединениях. Моноклинный β-Ga 2O3используется в газовых сенсорах и люминесцентных люминофорах и может наноситься на диэлектрические покрытия для солнечных элементов. Этот стабильный оксид также показал потенциал для использования в проводящих оксидах, прозрачных для глубокого ультрафиолета, и в транзисторах.
Тонкие пленки ε-Ga 2O3, нанесенные на сапфир, потенциально могут применяться в качестве солнцезащитного УФ-фотодетектора .
Тонкие пленки Ga 2O3представляют коммерческий интерес как газочувствительные материалы, а Ga 2O3. Эллипсометрия - это процедура, которую можно использовать для определения оптических функций β-Ga 2O3.
β-Ga 2O3. использованный в производстве катализатора Ga 2O3-Al 2O3.