 | |
| Имена | |
|---|---|
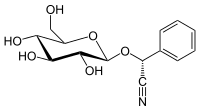
| Имя ИЮПАК (2R) -2-Фенил-2 - [( 2R, 3R, 4S, 5S, 6R) -3,4,5-тригидрокси-6- (гидроксиметил) оксан-2-ил] оксиацетонитрил | |
| Другие названия (R) -Пруназин. D-Прунасин. D-Манделонитрил-β- D -глюкозид. Прулауразин Лауроцеразин, Самбунигрин | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.002.489 |
| Номер EC |
|
| KEGG | |
| PubChem CID | |
| UNII | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C14H17NO6 |
| Молярная масса | 295,291 г · моль |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
(R) -prunasin - это цианогенный гликозид, относящийся к амигдалину. Химически это глюкозид из (R) - манделонитрил.
Prunasin обнаружен у видов рода Prunus, таких как Prunus japonica или P. maximowiczii и в горький миндаль. Он также встречается в листьях и стеблях Olinia ventosa, O. emarginata и в Acacia greggii. Это биосинтетический предшественник и промежуточный продукт в биосинтезе амигдалина, химического соединения, ответственного за вкус горького миндаля.
. Он также содержится в одуванчик кофе, заменитель кофе.
Самбунигрин, диастереомер пруназина, полученный из (S) -манделонитрила вместо его (R) -изомера, был выделен из листьев бузины. дерево (Sambucus nigra ). Самбунигрин присутствует в листьях и стеблях бузины в соотношении 1: 3 самбунигрина к пруназину и 2: 5 в незрелых семенах. Его не обнаруживают в корне.
(R) -прунасин начинается с распространенной аминокислоты фенилаланина, которая у растений продуцируется посредством пути шикимата в первичном метаболизме. Этот путь катализируется в основном двумя ферментами цитохрома P450 (CYP) и а (). После образования (R) -пруназина он либо превращается в амигдалин дополнительной UDP-глюкозилтрансферазой, либо разлагается на бензальдегид и цианистый водород.
Исследователи показали, что накопление (или отсутствие) пруназина и амигдалина в ядре миндаля является причиной сладких и горьких генотипов. Поскольку за горький миндальный вкус отвечает амигдалин, производители миндаля выбрали генотипы, которые минимизируют биосинтез амидгалина. Ферменты CYP, ответственные за образование prunasin, сохраняются у всех видов Prunus. Существует корреляция между высокой концентрацией чернослива в вегетативных областях растения и сладостью миндаля, что актуально для сельскохозяйственной отрасли миндаля. В миндале гены биосинтеза амигдалина экспрессируются на разных уровнях в тегументе (материнская ткань или внешняя часть) и семядоли (ядро или отцовская ткань), и значительно различаются в течение миндаля онтогенеза. Биосинтез пруназина происходит в тегументе, затем транспортируется в другие ткани для преобразования в амигдалин или разложения.
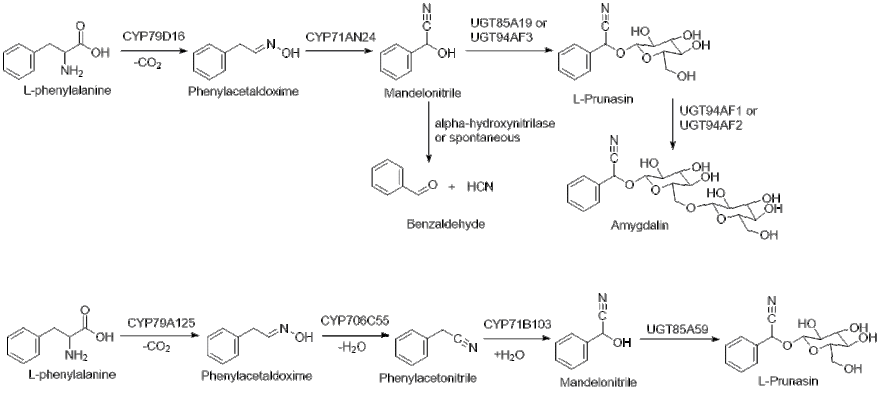 Биосинтетический путь производства (R) -пруназина в Prunus видов (вверху) и Eucalyptus cladocalyx (внизу)
Биосинтетический путь производства (R) -пруназина в Prunus видов (вверху) и Eucalyptus cladocalyx (внизу) L-фенилаланин сначала гидроксилируется CYP79D16 с последующим декарбоксилированием и дегидратацией с образованием E-оксима фенилацетальдоксим. Затем CYP71AN24 катализирует перегруппировку E-оксима в Z-оксим с последующей дегидратацией и гидроксилированием с образованием манделонитрила. Наконец, UGT85A19 или UGT94AF3 используют UDP-глюкозу для гликозилирования манделонитрила с образованием (R) -пруназина.
После образования (R) -пруназина продукт дополнительно гликозилируется в амидгалин посредством любого изоформа UGT94AF1 или UGT94AF2. Экспрессия UGTAF1 / 2 и пруназина гидролаз приводит к низкой общей концентрации (R) -пруназина в тканях миндаля. Важно отметить, что альфа- глюкозидаза или пруназингидролаза могут превращать (R) -пруназин в его предшественник, манделонитрил, который затем может спонтанно или ферментативно гидролизоваться до бензальдегида и цианистого водорода.
Было показано, что биосинтез (R) -пруназина в E. cladocalyx, дереве сахарной камеди синтезирует (R) -прунасин с использованием дополнительного промежуточного соединения, фенилацетонитрила, с использованием CYP706C55. Путь протекает аналогично пути у видов Prunus, где многофункциональный CYP79A125 катализирует превращение L-фенилаланина в фенилацетальдоксим. Затем CYP706C55 катализирует дегидратацию фенилацетальдоксима до фенилацетонитрила. Затем фенилацетонитрил гидроксилируется CYP71B103 до манделонитрила. После образования манделонитрила UGT85A59 переносит глюкозу в (R) -пруназин.
Поскольку (R) -пруназин является продуктом вторичного метаболизма, его образование и распад влияют на многие метаболические процессы. путем употребления L-фенилаланина или увеличения количества бензальдегида и токсичного цианистого водорода через деградацию пруназина.
Метаболический профиль миндаля, маниоки и сорго выявил потенциальный механизм рециркуляции, при котором (R) -прунасин и другие гликозиды цианогена могут быть использованы для хранения азота и рециркуляции азота без образования HCN. В 2017 году исследователи использовали метку стабильных изотопов, чтобы продемонстрировать, что C-меченый L-фенилаланин, включенный в (R) -пруназин, может быть преобразован в бензальдегид и салициловую кислоту с использованием нитрила миндалина в качестве промежуточного продукта.
Токсичность пруназина основана на его продуктах разложения: (R) -прунасин гидролизуется с образованием бензальдегида и цианистого водорода, что вызывает токсичность. Следовательно, растения, содержащие прунасин, могут быть токсичными для животных, в частности жвачных.
Для разложения амигдалина до пруназина бета-глюкозидаза амигдалина гидролизует дисахарид с образованием (R) -пруназина и D -глюкоза. Затем пруназин-бета-глюкозидаза использует (R) -пруназин и воду для получения D-глюкозы и нитрила манделонитрила. После образования агликона нитрила минделонитрила, лиаза манделонитрила может разлагать соединение на бензальдегид и цианистый водород.