 Механизм действия холерного токсина
Механизм действия холерного токсина Холерный токсин (также известный как холераген и иногда сокращенно CTX, Ctx или CT ) - это мультимерный белковый комплекс AB5, секретируемый бактерия Vibrio cholerae. CTX вызывает массивную водянистую диарею, характерную для инфекции холеры. Он является членом семейства термолабильных энтеротоксинов.
Токсин холеры был открыт в 1959 году индийским микробиологом Самбху Натх Де.
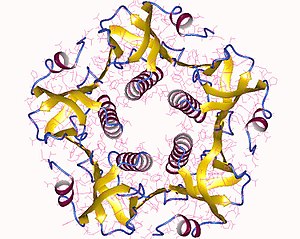 Пентамер холерного токсина B, Vibrio cholerae.
Пентамер холерного токсина B, Vibrio cholerae. Холерный токсин представляет собой олигомерный комплекс, состоящий из шести белковых субъединиц: единственная копия субъединицы A (часть A, ферментативная, P01555 ) и пять копий субъединицы B (часть B, рецепторное связывание, P01556 ), обозначенных как AB 5. Субъединица B связывается, а субъединица A активирует G-белок, который активирует аденилатциклазу. Трехмерная структура токсина была определена с использованием рентгеновской кристаллографии Zhang et al. в 1995.
Пять субъединиц B - каждая весом 11 кДа, образуют пятичленное кольцо. Субъединица А, имеющая 28 кДа, имеет два важных сегмента. Часть цепи A1 (CTA1) представляет собой глобулярный фермент полезную нагрузку, которая ADP -рибозилирует G-белки, в то время как цепь A2 (CTA2) образует удлиненный альфа-спираль, которая плотно прилегает к центральной поре кольца субъединицы B.
Эта структура аналогична по форме, механизму и последовательности с тепло- лабильный энтеротоксин, секретируемый некоторыми штаммами бактерии Escherichia coli.
Холерный токсин действует по следующему механизму: во-первых, кольцо субъединицы B холерного токсина связывается с GM1 ганглиозидами на поверхности клеток-мишеней. Если в клетке отсутствует GM1, токсин, скорее всего, связывается с другими типами гликанов, такими как Lewis Y и Lewis X, прикрепленными к белкам вместо липидов. После связывания весь токсиновый комплекс эндоцитозируется клеткой, и цепь холерного токсина A1 (CTA1) высвобождается за счет восстановления дисульфидного мостика. Эндосома перемещается в аппарат Гольджи, где белок A1 распознается шапероном эндоплазматического ретикулума, протеиндисульфидизомеразой. Затем цепь A1 разворачивается и доставляется к мембране, где Ero1 запускает высвобождение белка A1 путем окисления комплекса протеин-дисульфид-изомеразы. Поскольку белок A1 перемещается из ER в цитоплазму по каналу Sec61, он повторно складывается и избегает дезактивации в результате убиквитинирования.
CTA1 затем может свободно связываться с человеческим белком-партнером, называемым фактором 6 АДФ-рибозилирования (Arf6); Связывание с Arf6 приводит к изменению формы CTA1, который обнажает его активный центр и обеспечивает его каталитическую активность. Фрагмент CTA1 катализирует ADP-рибозилирование белков альфа-субъединицы Gs (Gα s) с использованием NAD. ADP-рибозилирование заставляет субъединицу Gα s терять свою каталитическую активность гидролиза GTP до GDP + P i, таким образом поддерживая Gα s в активированном состоянии. Повышенная активация Gα s приводит к повышенной активности аденилатциклазы, что увеличивает внутриклеточную концентрацию 3 ', 5'-циклического AMP (цАМФ) до более чем 100 -складывается сверх нормы и чрезмерно активирует цитозольную PKA. Эти активные PKA затем фосфорилируют белки хлорных каналов регулятора трансмембранной проводимости муковисцидоза (CFTR), что приводит к АТФ-опосредованному оттоку хлоридных ионов и секреции H2O, Na, K и HCO 3 в просвет кишечника. Кроме того, уменьшается поступление натрия и, следовательно, воды в энтероциты. Комбинированные эффекты приводят к быстрой потере жидкости из кишечника, до 2 литров в час, что приводит к тяжелому обезвоживанию и другим факторам, связанным с холерой, включая стул с рисовой водой.
токсин коклюша (также белок AB 5), продуцируемый Bordetella pertussis, действует аналогичным образом, за исключением того, что он ADP-рибозилирует Gαiсубъединицу, что делает его неспособным ингибировать продукцию цАМФ.
Ген, кодирующий токсин холеры, вводится в V. cholerae посредством горизонтального переноса гена. Вирулентные штаммы V. cholerae содержат вирус, известный как бактериофаг CTXφ.
Поскольку субъединица B кажется относительно нетоксичной, исследователи обнаружили ряд приложений к ней в клеточной и молекулярной биологии. Он обычно используется в качестве нейронального индикатора.
. Обработка культивированных нервных стволовых клеток грызунов холерным токсином вызывает изменения в локализации фактора транскрипции Hes3 и увеличивает их количество.
Ганглиозиды GM1 обнаруживаются в липидных рафтах на поверхности клетки. Комплексы субъединиц В, меченные флуоресцентными метками или впоследствии нацеленные антителами, могут быть использованы для идентификации рафтов.
1. De SN. Энтеротоксичность бактериального фильтрата культуры Vibrio cholerae. Природа. 1959; 183: 1533–4.