 Комплекс, стимулирующий анафазу (APC), представляет собой большой белковый комплекс, содержащий 11–13 субъединиц, включая субъединицу RING (Apc11) и куллин (Apc2). Активность APC требует ассоциации с субъединицами активатора (Cdc20 или Cdh1), которые способствуют связыванию субстрата.
Комплекс, стимулирующий анафазу (APC), представляет собой большой белковый комплекс, содержащий 11–13 субъединиц, включая субъединицу RING (Apc11) и куллин (Apc2). Активность APC требует ассоциации с субъединицами активатора (Cdc20 или Cdh1), которые способствуют связыванию субстрата. Анафазный комплекс (также называемый циклосомой или APC / C ) представляет собой E3 убиквитинлигазу, которая маркирует белки-мишени клеточного цикла для деградации 26S протеасомой. APC / C представляет собой большой комплекс из 11–13 субъединиц белков, включая субъединицу кулина (Apc2) и RING (Apc11), очень похожую на SCF. Другие части APC / C до сих пор выполняют неизвестные функции, но являются высококонсервативными.
Это было открытие APC / C (и SCF ) и их ключевой роли в воспроизводстве эукариотических клеток. которые раз и навсегда установили важность убиквитина -опосредованного протеолиза в биологии эукариотических клеток. Когда-то считавшееся системой, исключительно участвующей в удалении поврежденного белка из клетки, убиквитинирование и последующая деградация белка протеасомой теперь воспринимается как универсальный регуляторный механизм для передачи сигнала, важность которого приближается к тому, что фосфорилирования белка .
В 2014 году APC / C был картирован в 3D с разрешением менее нанометра, что также выявило его вторичную структуру. Исследователи заявили, что это открытие может изменить понимание рака и выявить новые сайты связывания для будущих противораковых препаратов.
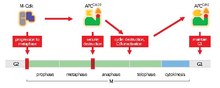 Активность M – Cdk способствует событиям раннего митоза, что приводит к метафазному выравниванию сестринских хроматид на веретене. Активность M-Cdk также способствует активации APCCdc20, который запускает анафазу и выход из митоза, стимулируя разрушение регуляторных белков, таких как securin и cyclins, которые управляют этими событиями. Способствуя разрушению циклина и, таким образом, инактивации Cdk, APCCdc20 также запускает активацию APCCdh1, тем самым обеспечивая продолжение активности APC в G1.
Активность M – Cdk способствует событиям раннего митоза, что приводит к метафазному выравниванию сестринских хроматид на веретене. Активность M-Cdk также способствует активации APCCdc20, который запускает анафазу и выход из митоза, стимулируя разрушение регуляторных белков, таких как securin и cyclins, которые управляют этими событиями. Способствуя разрушению циклина и, таким образом, инактивации Cdk, APCCdc20 также запускает активацию APCCdh1, тем самым обеспечивая продолжение активности APC в G1. Основная функция APC / C - запускать переход от метафазы к анафаза, помечая определенные белки для деградации. Тремя основными объектами разложения APC / C являются секурин и S и M циклины. Securin высвобождает separase (протеазу) после разложения. Сепараза запускает расщепление когезина, белкового комплекса, который связывает сестринские хроматиды вместе. Во время метафазы сестринские хроматиды связаны интактными когезиновыми комплексами. Когда секурин подвергается убиквитинированию с помощью APC / C и высвобождает сепаразу, которая разрушает когезин, сестринские хроматиды становятся свободными перемещаться к противоположным полюсам для анафазы. APC / C также нацелен на митотические циклины для деградации, что приводит к инактивации комплексов M-CDK (митотическая циклин-зависимая киназа ), способствуя выходу из митоза и цитокинез
В отличие от SCF, субъединицы активатора контролируют APC / C. Cdc20 и Cdh1 являются двумя активаторами, имеющими особое значение для клеточного цикла. Эти белки нацелены на APC / C на определенные наборы субстратов в разное время клеточного цикла, тем самым продвигая его вперед. APC / C также играет важную роль в поддержании метаболизма хроматина, особенно в G1 и G0, и играет ключевую роль в фосфорилировании H3 посредством разрушения киназы Aurora A.
Критические субстраты APC / C, по-видимому, представляет собой секурин и циклины типа B. Это сохраняется у млекопитающих и дрожжей. Фактически, дрожжи жизнеспособны в отсутствие APC / C, если устранена потребность в нацеливании на эти два субстрата.
Нет большого количества обширных исследований по APC / Подблоки C, которые в основном служат адаптерами. Исследования субъединиц АРС в основном проводятся у дрожжей, и исследования показывают, что большинство субъединиц АРС дрожжей также присутствует у позвоночных, что предполагает сохранение у эукариот. Одиннадцать основных субъединиц APC были обнаружены у позвоночных по сравнению с тринадцатью у дрожжей. Субъединицы активатора связываются с APC на различных стадиях клеточного цикла, чтобы контролировать его активность убиквитинирования, часто путем направления APC к субстратам-мишеням, предназначенным для убиквитинирования. Предлагается контролировать специфичность лигаз APC путем включения факторов специфичности в лигазный комплекс вместо фосфорилирования субстрата. то есть: субъединица CDC20 позволяет APC разлагать субстраты, такие как ингибиторы анафазы (Pdsp1), в начале анафазы, с другой стороны, когда CDC20 заменяется фактором специфичности Hct1, APC разрушает другой набор субстратов, особенно митозные циклины на поздних стадиях. анафаза. Активаторы CDC20 и Cdh1 имеют особое значение и являются наиболее широко изученными и известными из субъединиц APC / C.
Каталитическое ядро APC / C состоит из субъединицы целлина Apc2 и субъединицы домена RING H2 Apc11. Эти две субъединицы катализируют убиквитинирование субстратов, когда C-концевой домен Apc2 образует прочный комплекс с Apc11. RING / APc11 связывается с конъюгатом E2-убиквитин, который катализирует перенос убиквитина к активному центру в E2. В дополнение к каталитической функциональности другие коровые белки APC состоят из множества повторяющихся мотивов с основной целью обеспечения поддержки молекулярного каркаса. К ним относятся Apc1, самая большая субъединица, которая содержит 11 тандемных повторов из 35-40 аминокислотных последовательностей, и Apc2, который содержит три cullin повтора, всего примерно 130 аминокислот. Основные мотивы в субъединицах APC включают тетратрикопептидные (TPR) мотивы и повторы WD40 1. С-концевые области CDC20 и Cdh1 имеют домен WD40, который, как предполагается, формирует платформу связывания, которая связывает субстраты APC, тем самым способствуя способности APC нацеливаться на них. субстраты, хотя точный механизм, посредством которого они увеличивают активность APC, неизвестен. Также предполагается, что вариации в этих доменах WD40 приводят к различной субстратной специфичности, что подтверждается недавними результатами, предполагающими, что разные субстраты APC могут напрямую и специфически связываться с Cdc20 и Cdh1 / Hct1. В конечном итоге различия в специфичности ответственны за время появления разрушение нескольких мишеней APC во время митоза. CDC20 нацелен на несколько основных субстратов в метафазе, а Cdh1 нацелен на более широкий диапазон субстратов в сторону позднего митоза и G1.
В частности, 4 субъединицы дрожжевого APC / C почти полностью состоят из множественных повторов 34 аминокислот. мотив тетратрикопептидного остатка (TPR). Эти субъединицы TPR, Cdc16 и Apc5, в основном обеспечивают каркас и поддержку для опосредования других белок-белковых взаимодействий. Было показано, что Cdc27 и Cdc23 поддерживают связывание Cdc20 и Cdh1, поскольку мутации в ключевых остатках этих субъединиц приводили к повышенной диссоциации активаторов. Было показано, что Apc10 / Doc1 способствует связыванию субстрата, опосредуя их взаимодействия с Cdh1 и Cdc20.
В частности, CDC20 (также известный как p55CDC, Fizzy или Slp1) инактивирует CDK1 посредством убиквитинирования циклинов B-типа.. Это приводит к активации Cdh1 (он же Fizzy-related, Hct1, Ste9 или Srw1), который взаимодействует с APC во время позднего митоза и G1 / G0. Cdh1 инактивируется посредством фосфорилирования во время S, G2 и ранней M фазы. Во время этих точек цикла он не может быть собран.
Данные показывают, что APC3 и APC7 служат для рекрутирования Cdh1 в комплекс, способствующий анафазе. Это также подтверждает, что Cdh1 отвечает за поддержание активности APC во время G1. Cdh1 не требует фосфорилирования APC для связывания, фактически фосфорилирование Cdh1 с помощью Cdks предотвращает его связывание с APC из фазы S в M. При разрушении M-Cdk теперь может происходить высвобождение CDC20 из APC и связывания Cdh1, позволяя активности APC продолжаться во время входа в G1. Хотя Cdh1 распознает циклины M и S, позволяя их разрушение до тех пор, пока вся клетка не перейдет к новому циклу, он не распознает циклины G1 / S, и во время фазы G1 / S их активность циклинов может беспрепятственно возрастать и фосфорилироваться и, таким образом, инактивация Cdh1 и, следовательно, APC.
Субъединица Apc15 играет важную роль в активации APC / C после би-ориентации сестринских хроматид через метафазную пластинку. Когда кинетохоры не прикреплены к веретенам, комплексы митотических контрольных точек (MCC) ингибируют APC. В отсутствие Apc15 MCC и Cdc20 остаются заблокированными на APC / C, предотвращая его активность, как только выполняются требования контрольной точки шпинделя. Apc15 опосредует оборот Cdc20 и MCC для предоставления информации о состоянии прикрепления кинетохор.
CDC27, одна из субъединиц, демонстрирующих мотив TPR, как было установлено, взаимодействует с белки митотических контрольных точек, такие как Mad2, p55CDC и BUBR1, что позволяет предположить, что он может участвовать во времени М-фазы. Данные показывают, что CDC27 участвует в тройном комплексе с SMAD2 / 3 и Cdh1, который создается в ответ на передачу сигналов TGFβ. В частности, благодаря взаимодействию с Cdh1, он играет потенциальную роль в определении сродства между APC и его активаторами Cdc20 и Cdh1. Исследование предполагает, что индуцированное TGF-β фосфорилирование Cdc27 усиливает взаимодействие между cdc27 и Cdh1, который непосредственно участвует в активации APC. CDC27 может служить средством, с помощью которого передача сигналов TGFβ может активировать APC. Вызванное TGFβ гиперфосфорилирование CDC27 показало повышенную активность APC.
CDC23, другая субъединица TPR взаимодействует с SWM1, связываясь с D-боксом CLB2. На основании гибридных анализов in vivo и совместной иммунопреципитации in vitro предполагается, что Cdc16p, Cdc23p и Cdc27p (аналоги Sacchyromyces cerevisiae) взаимодействуют и образуют макромолекулярный комплекс. Предполагается, что их общая тема TPR опосредует эти взаимодействия. Что касается Cdc27 и Cdc16 у дрозофилы, их функции были протестированы с помощью РНК-интерференции (РНКи). Результаты показывают, что они могут опосредовать активность всего комплекса с помощью разных механизмов в разных местах. В дальнейших исследованиях дрозофилы Cdk16 и cdk23, по-видимому, активируются посредством фосфорилирования Polo-подобной киназой 1 (Plk1) и ее аналогом из делящихся дрожжей, и, по-видимому, связываются, в частности, с Cdc23. активаторы CDC20 и Cdh1 во время митоза. Их роль в деградации циклина B продемонстрирована скринингом мутантов Saccharomyces cerevisiae, дефектных по деградации циклина B, которые, как было обнаружено, имеют мутации в генах CDC16 и CDC23. Все мутанты CDC27, CDC23 и CDC 27 привели к остановке клеточного цикла в метафазе.
Субстраты APC / C имеют аминокислотные последовательности узнавания, которые позволяют APC / C идентифицировать их. Наиболее распространенная последовательность известна как блок разрушения или D-блок. APC / C объединяет E2 убиквитин-конъюгированный фермент и D-бокс, а не является промежуточным ковалентным носителем. D-бокс должен иметь версию следующей аминокислотной последовательности: RXXLXXXXN, где R - аргинин, X - любая аминокислота, L - лейцин, и N представляет собой аспарагин. Коробка Кен - еще один важный мотив. Его последовательность должна напоминать следующую: KENXXXN, где K - лизин, а E - глутамат. Положение последней аминокислоты в Ken-боксе сильно варьирует. Хотя было показано, что мутации в последовательностях действительно ингибируют разрушение белков «in vivo», еще многое предстоит узнать о том, как белки нацелены на APC / C.
После связывания с APC / C, Cdc20 и Cdh1 служат рецепторами D- и KEN-бокса для различных субстратов APC. Kraft et al. показали, что D-боксы субстратов непосредственно связываются с высококонсервативной пропеллерной областью повтора WD40 на активаторах APC. Важно отметить, что консервативная область пропеллера Cdh1 намного больше, чем у Cdc20, что позволяет Cdh1 иметь более широкую субстратную специфичность, что согласуется с тем фактом, что APC / C также активирует APC-опосредованное разрушение субстратов, содержащих KEN-бокс.. D-бокс дополнительно усиливает деградацию белка, поскольку остатки лизина в непосредственной близости от D-бокса служат мишенями для убиквитилирования. Было обнаружено, что остаток Lys, расположенный непосредственно на С-конце по отношению к D-боксу, может функционировать как акцептор убиквитина.
Многие субстраты APC содержат как D-, так и KEN-боксы с их убиквитилированием либо APC / C, либо APC / C зависит от обеих последовательностей, однако некоторые субстраты содержат только блок D или блок KEN в одной или нескольких копиях. Наличие двух различных последовательностей деградации создает высокий уровень субстратной специфичности на APC / C, причем APC / C больше зависит от D-бокса, а APC / C больше зависит от KEN-бокса. Например, APC / C способен убиквитилировать субстраты, содержащие только KEN-бокс, такие как Tome-1 и Сорорин.
Хотя Cdc20 и Cdh1 могут служить рецепторами D- и KEN-бокса, низкое сродство этих ко- Взаимодействия активатор-субстрат предполагают, что маловероятно, что коактиваторов одних достаточно, чтобы обеспечить связывание субстрата с высокой аффинностью с APC / C и APC / C. Следовательно, основные субъединицы APC / C, такие как Apc10, также вносят вклад в ассоциацию с субстратом. В конструкциях APC / C, лишенных субъединицы Apc10 / Doc1, субстраты, подобные Clb2, не могут связываться с APC-Cdh1, тогда как добавление очищенного Doc1 к конструкции APC-Cdh1 восстанавливает способность связывания субстрата.
Когда начинается метафаза, контрольная точка веретена ингибирует APC / C до тех пор, пока все сестринские кинетохоры не присоединятся к противоположным полюсам митотического веретена, процесс, известный как биориентация хромосом. Когда все кинетохоры правильно прикреплены, контрольная точка шпинделя заглушается, и APC / C может стать активным. M-Cdks фосфорилирует субъединицы APC / C, которые способствуют связыванию с Cdc20. Секурин и М-циклины (циклин A и циклин B) затем становятся мишенью APC / C для деградации. После разложения сепарин высвобождается, когезин разрушается, и сестринские хроматиды подготавливаются к перемещению к своим полюсам для анафазы.
Вероятно, что в клетках животных происходит по крайней мере некоторая активация APC / C в начале клеточного цикла (профаза или прометафаза) в зависимости от времени деградации его субстратов. Циклин A разлагается на ранних этапах митоза, что подтверждает теорию, но циклин B и секурин не разлагаются до метафазы. Молекулярная основа задержки неизвестна, но считается, что она является ключом к правильному времени инициации анафазы. В клетках животных система контрольных точек веретена вносит свой вклад в задержку, если ей необходимо исправить би-ориентацию хромосом. Хотя как система контрольных точек веретена ингибирует разрушение циклина B и секурина, позволяя при этом разрушаться циклину A, неизвестно. Задержка также может быть объяснена неизвестными взаимодействиями с регуляторами, изменениями локализации и фосфорилирования.
Это инициирует петлю отрицательной обратной связи. В то время как для активации APC / C требуется M-Cdk, этот комплекс также отвечает за разрушение циклина, чтобы дезактивировать M-CdK. Это означает, что APC / C способствует собственной деактивации. Возможно, что эта отрицательная обратная связь является основой активности Cdk, контролируемой колебаниями концентрации циклинов M и S.
По завершении митоза, Важно, чтобы клетки (за исключением эмбриональных) прошли период роста, известный как G1фаза, чтобы расти и производить факторы, необходимые для следующего клеточного цикла. Вступление в другой раунд митоза предотвращается за счет ингибирования активности Cdk. Хотя за это ингибирование ответственны разные процессы, важным является активация APC / C с помощью Cdh1. Эта продолжающаяся активация предотвращает накопление циклина, который запускает следующий раунд митоза, и вместо этого запускает выход из митоза.
В начале клеточного цикла Cdh1 фосфорилируется M-Cdk, предотвращая его прикрепление к APC / С. После этого APC / C может присоединиться к Cdc20 и начать переход от метафазы к анафазе. По мере того, как M-Cdk деградирует позже в митозе, Cdc20 высвобождается, и Cdh1 может связываться с APC / C, сохраняя его активированным посредством перехода M / G 1. Ключевое различие, которое следует отметить, заключается в том, что хотя связывание Cdc20 с APC / C зависит от фосфорилирования APC / C митотическими Cdks, связывание Cdh1 не зависит. Таким образом, поскольку APC становится инактивированным во время метафазы из-за дефосфорилирования в результате неактивных митотических Cdks, Cdh1 способен немедленно связываться с APC / C, занимая место Cdc20. Cdc20 также является целью APC / C, обеспечивая выключение APC / C. Затем APC / C продолжает работу в G 1, чтобы пометить циклины S и M для уничтожения. Однако циклины G 1 / S не являются субстратами APC / C и поэтому накапливаются на протяжении всей этой фазы и фосфорилируют Cdh1. К концу G 1, достаточное количество циклинов G 1 / S накопило и фосфорилировало Cdh1, чтобы инактивировать APC / C до следующей метафазы.
Однажды в G 1, APC отвечает за деградацию различных белков, которые способствуют правильному развитию клеточного цикла. Геминин - это белок, который связывается с Cdt1, что предотвращает его связывание с комплексом распознавания источника (ORC). APC нацелен на геминин для убиквитинирования в G 1, сохраняя его уровни на низком уровне. Это позволяет Cdt1 выполнять свою функцию во время предварительной сборки RC. Когда APC становится неактивным из-за фосфорилирования Cdh1 циклинами G 1 / S, активность геминина снова увеличивается. Кроме того, Dbf4 стимулирует активность протеинкиназы (Cdc7), относящейся к 7-му циклу деления клетки, что способствует активации источников репликации. Предполагается, что APCCdh1 нацелен на уничтожение Dbf4. Это могло бы дать ответ на вопрос, как Cdc7 активируется в начале нового клеточного цикла. Его активность, вероятно, соответствует инактивации APC / C циклинами G / S.
Инактивация APC / C на ранних стадиях клеточного цикла частично достигается белком Emi1. Первоначальные эксперименты показали, что добавление Emi1 к циклическим экстрактам Xenopus может предотвратить разрушение эндогенного циклина A, циклина B и выход из митоза, предполагая, что Emi1 способен противодействовать активности APC. Кроме того, истощение Emi1 в соматических клетках приводит к недостаточному накоплению циклина B. Отсутствие Emi1, вероятно, приводит к отсутствию ингибирования APC, предотвращая накопление циклина B.
Из этих ранних наблюдений следует Было подтверждено, что в G2 и ранних митозах Emi1 связывает и ингибирует Cdc20, предотвращая его ассоциацию с субстратами APC. Cdc20 все еще может фосфорилироваться и связываться с APC / C, но связанный Emi1 блокирует взаимодействие Cdc20 с мишенями APC. Связь Emi1 с Cdc20 позволяет стабилизировать различные циклины на протяжении фаз S и G2, но удаление Emi1 важно для прогрессирования через митоз. Таким образом, в поздней профазе Emi1 фосфорилируется Polo-подобной киназой, Plk. Plk активируется во время раннего митоза за счет активности Cdk1, и его фосфорилирование сайта связывания Emi1 BTRC (ген) βTrCP делает его мишенью для SCF, что приводит к его последующему разрушению в прометафазе. Разрушение Emi1 приводит к активации APC / CCdc20, что делает возможным разрушение циклина А в раннем митозе. Уровни Emi1 снова начинают расти в G, что помогает ингибировать APC / C.
Регуляция активности APC / C в отношении метафазных субстратов, таких как секурин и циклин B, может быть результатом внутриклеточной локализации. Предполагается, что белки контрольных точек веретена, которые ингибируют APC / C, ассоциируют только с подмножеством популяции Cdc20, локализованной около митотического веретена. Таким образом, циклин A может разлагаться, в то время как циклин B и секурин разлагаются только после того, как сестринские хроматиды достигли би-ориентации.