 | |
 | |
 | |
| Имена | |
|---|---|
| Название IUPAC Дихромат аммония | |
| Другие имена Бихромат аммония. Пирохромат аммония | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.221 |
| PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1439 |
| Панель управления CompTox (EPA ) | |
InChI
| |
SMILES
| |
| Свойства | |
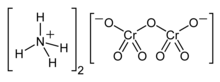
| Химическая формула | (NH 4)2Cr2O7 |
| Молярная масса | 252,07 г / моль |
| Внешний вид | Оранжево-красные кристаллы |
| Плотность | 2 0,115 г / см |
| Температура плавления | 180 ° C (356 ° F; 453 K) разлагается |
| Растворимость в воде | 18,2 г / 100 мл (0 ° C). 35,6 г / 100 мл (20 ° C). 40 г / 100 мл (25 ° C). 156 г / 100 мл (100 ° C) |
| Растворимость | не растворим в ацетон. растворим в спирте |
| Опасности | |
| Основные опасности | Очень токсичен, взрывоопасен, окислитель, канцероген, мутаген, опасен для окружающей среды |
| Паспорт безопасности | ICSC 1368 |
| Пиктограммы GHS |       |
| Указания на опасность GHS | H272, H301, H312, H314, H317, H330, H334, H340, H350, H360, H372, H410 |
| Меры предосторожности GHS | P201, P220, P260, P273, P280, P284 |
| NFPA 704 (огненный алмаз) |  2 4 3 OX 2 4 3 OX |
| Температура самовоспламенения. | 190 ° C (374 ° F; 463 K) |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 20-250 мг / кг |
| Родственные соединения | |
| Другое катионы | дихромат калия. дихромат натрия |
| Excep t если указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Дихромат аммония представляет собой неорганическое соединение с формулой (NH 4)2Cr2O7. В этом соединении, как и во всех хроматах и дихроматах, хром находится в +6 степени окисления, обычно известном как шестивалентный хром. Это соль, состоящая из ионов аммония и ионов дихромата.
Дихромат аммония иногда называют Везувианским огнем из-за его использования в демонстрациях настольных «вулканов». Однако эта демонстрация стала непопулярной в школах из-за канцерогенной природы соединения. Он также использовался в пиротехнике и на заре фотографии.
При комнатной температуре и давлении, соединение существует в виде оранжевых кислотных кристаллов, растворимых в воде и спирте. Он образуется под действием хромовой кислоты на гидроксид аммония с последующей кристаллизацией.
Кристалл (NH 4)2Cr2O7(C2 / c, z = 4) содержит один тип иона аммония в узлах симметрии C 1 (2,3). Каждый центр NH 4 нерегулярно окружен восемью атомами кислорода на расстояниях N — O в диапазоне от от примерно 2,83 до примерно 3,17 Å, типично для водородных связей.
Он использовался в пиротехнике и в первые дни фотографии, а также в литография, как источник чистого азота в лаборатории и катализатор. Также используется как протрава для окрашивания пигментов., при производстве ализарина, хромовых квасцов, дублении кожи и очистке масел.
Фоточувствительные пленки, содержащие PVA, дихромат аммония и люминофор наносится методом центрифугирования в виде водных суспензий при производстве люминофора для телевизионных экранов и других устройств. Дихрома аммония он действует как фотоактивный центр.
 Play media Несколько капель этанола добавляют к небольшой кучке дихромата аммония ((NH 4)2Cr2O7) и загорелся. Выделяются искры и образуется пепел. Явление напоминает извержение вулкана. Реакция начинается при 180 ° С и становится самоподдерживающейся примерно при 225 ° С.
Play media Несколько капель этанола добавляют к небольшой кучке дихромата аммония ((NH 4)2Cr2O7) и загорелся. Выделяются искры и образуется пепел. Явление напоминает извержение вулкана. Реакция начинается при 180 ° С и становится самоподдерживающейся примерно при 225 ° С.  Разложение дихромата аммония
Разложение дихромата аммония Демонстрация вулкана включает зажигание кучи соли, что инициирует следующее экзотермическое превращение: -
Как нитрат аммония, он термодинамически нестабилен. После инициирования реакция его разложения завершается с образованием объемного темно-зеленого порошка оксида хрома (III). В этой реакции разлагается не весь дихромат аммония. зеленый порошок вносят в воду; из остатков дихромата аммония получают раствор желто-оранжевого цвета.
Наблюдения, полученные с помощью микроскопии с относительно большим увеличением во время кинетического исследования термического разложения дихромата аммония, подтвердили, что распад соли продолжается с вмешательством промежуточной жидкой фазы, а не твердой фазы. Характерное потемнение кристаллов (NH. 4). 2Cr. 2O. 7как следствие начала разложения можно приписать диссоциативной потере аммиака, сопровождающейся прогрессирующей конденсацией анионов до Cr. 3O. 10, Cr. 4O. 13и т. д., что в конечном итоге дает CrO. 3. CrO. 3был идентифицирован как возможное расплавленное промежуточное соединение, участвующее в разложении (NH. 4). 2Cr. 2O. 7.
Дихромат аммония является сильным окислителем и реагирует, часто бурно, с любым восстанавливающим агентом. Чем сильнее восстанавливающий агент, тем интенсивнее реакция. Его также использовали для ускорения окисления спиртов и тиолов. Дихромат аммония в присутствии Mg (HSO 4)2и влажный SiO 2 может действовать как очень эффективный реагент для окислительного сочетания тиолов в условиях отсутствия растворителя. Реакции дают достаточно хорошие дает в относительно мягких условиях. Соединение также используется при окислении алифатических спиртов до их соответствующих альдегидов и кетонов в ZrCl 4 / влажный SiO 2 в условиях отсутствия растворителя, опять же с относительно высокими выходами.
Дихромат аммония, как и все соединения хрома (VI), очень токсичен и доказанный канцероген. Также это сильный раздражитель.
В закрытых контейнерах дихромат аммония может взорваться при нагревании. В 1986 году на предприятии Diamond Shamrock Chemicals в Аштабула, Огайо, два рабочих были убиты и 14 ранены, когда 2 000 фунтов дихромата аммония взорвались, когда он сушился в обогревателе.
| На Викискладе есть средства массовой информации, связанные с дихроматом аммония. |