| Малонил-КоА: ACP Transacylase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер EC | 2.3.1.39 | ||||||||
| Номер CAS | 37257-17-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
В энзимологии, [ацил-носитель-белок] S- малонилтрансфераза (EC 2.3.1.39 ) представляет собой фермент, который катализирует химическую реакцию
Таким образом, два субстрата этого фермента - это малонил-CoA и ацильный белок-носитель, а его tw o продуктами являются КоА и малонилацил-белок-носитель. Этот фермент принадлежит к семейству трансфераз, в частности тех ацилтрансфераз, переносящих группы, отличные от аминоацильных групп. Этот фермент участвует в биосинтезе жирных кислот.
систематическое название этого класса ферментов - малонил-КоА : [ацил-белок-носитель] S-малонилтрансфераза. Другие широко используемые названия включают трансацилазу белка-носителя малонил-коэнзима А-ацила,
Кристаллические структуры FabD из E.coli и Streptomyces coelicolor известны и обеспечивают отличные понимание каталитического механизма FabD. В E.Coli FabD в первую очередь участвует в пути FAS. Однако у Streptomyces coelicolor FabD участвует в путях FAS и поликетидсинтазы. В обоих случаях структуры и активные сайты очень похожи.
 Воспроизведение мультимедиа Кристаллическая структура (ацил-носитель-белок) S-малонилтрансферазы (FabD) в E.Coli уточняется с разрешением 1,5A до R-фактора 0,19l. Активный сайт показан в виде сетки.
Воспроизведение мультимедиа Кристаллическая структура (ацил-носитель-белок) S-малонилтрансферазы (FabD) в E.Coli уточняется с разрешением 1,5A до R-фактора 0,19l. Активный сайт показан в виде сетки. Белок имеет архитектуру типа α / β, но складка уникальна. активный центр, полученный из расположения каталитического Ser92, содержит типичный нуклеофильный изгиб, наблюдаемый в α / β гидролазах. Серин 92 связан водородными связями с His 201 аналогично различным сериновым гирдолазам. однако вместо карбоновой кислоты, обычно присутствующей в каталитических триадах, карбонил основной цепи Gln 250 служит акцептором водородной связи при взаимодействии с His 201. Два других остатка, Arg-117 и Glu-11, также расположены в активном сайт, но их функция не ясна.
Путь синтеза жирных кислот является основным путем производства ацильных цепей мембран фосфолипидов у бактерий и растений. Последовательность реакции осуществляется серией отдельных растворимых белков, каждый из которых кодируется отдельным геном, а промежуточные продукты пути перемещаются между ферментами. Малони-КоА: АСР-трансацилаза (FabD) является одним из таких индивидуальных растворимых белков и катализирует следующую реакцию:
Переход малоната в ацильный белок-носитель (АСР) превращает ацильные группы в тиоэфирные формы, которые характерны для ацильных промежуточных продуктов в синтезе жирных кислот и которые строго необходимы для реакций конденсации, катализируемых β -кетоацил-АПФ-синтетаза.
Малонил-КоА: АСР-трансацилаза использует кинетический механизм «пинг-понг» со связанным сложным эфиром малоновой кислоты в качестве промежуточного ацила, присоединенного к остаток серина, находящийся в пентапептиде GHSLG. Сначала FabD связывает малонил-КоА, затем малонильный фрагмент переносится на активный сайт Ser 92, и КоА высвобождается из фермента. Затем АСР связывается, и малонильный фрагмент переносится на концевой сульфгидрил простетической группы АСР. Эта реакция легко обратима.
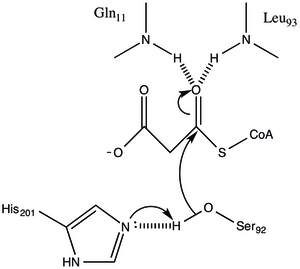 Реакция FabD происходит по механизму пинг-понга. На этом первом этапе малонат переносится с малонил-коА на Ser 92 в активном центре. His201 играет роль в активации Ser92 для нуклеофильной атаки на поступающий тиоэфир. Затем функциональная группа CoA-SH высвобождается из фермента с последующим связыванием ACP.
Реакция FabD происходит по механизму пинг-понга. На этом первом этапе малонат переносится с малонил-коА на Ser 92 в активном центре. His201 играет роль в активации Ser92 для нуклеофильной атаки на поступающий тиоэфир. Затем функциональная группа CoA-SH высвобождается из фермента с последующим связыванием ACP.  His201 активирует тиол ACP для нуклеофильной атаки на промежуточное соединение малонил-Ser92 (полученное на предыдущем этапе), способствуя его переносу в тиол ACP
His201 активирует тиол ACP для нуклеофильной атаки на промежуточное соединение малонил-Ser92 (полученное на предыдущем этапе), способствуя его переносу в тиол ACP Среди всех известных метаболических путей в живых системах биосинтез жирных кислот дает наиболее энергоемкие продукты. В результате производные микробных жирных кислот становятся многообещающей альтернативой возобновляемым источникам энергии транспортным топливам, получаемым из ископаемого топлива. Недавно Khosla et al. разработали процедуру восстановления синтазы жирных кислот E.Coli с использованием очищенных белковых компонентов (включая FabD) и сообщили о подробном кинетическом анализе этой восстановленной системы in vitro. Их открытие обеспечивает новую основу для оценки масштабов и ограничений использования E.Coli в качестве биокатализатора для производства дизельного топлива.
Биосинтез жирных кислот осуществляется повсеместно распространенной синтазой жирных кислот. Пути синтазы жирных кислот делятся на две отдельные молекулярные формы: тип I и тип II. В типе I синтаза жирных кислот (обнаруживается у людей и других млекопитающих) представляет собой один большой полипептид, состоящий из нескольких отдельных доменов. С другой стороны, каждая ферментативная активность (реакция конденсации, реакция восстановления, реакция дегидратации ) обнаруживается как отдельный белок в системах типа II. Различие в организации активного центра и преобладание систем FAS типа II у бактерий делает ферменты этого пути привлекательными мишенями для антибактериальных средств.
FabD (ацил-носитель-белок S-малонилтрансфераза) является разумной мишенью, учитывая, что доступна кристаллическая структура с высоким разрешением. Однако ни о каких ингибиторах FabD не сообщалось в литературе и обзорных статьях по этой теме. Простая структура и кислотность малоната, по-видимому, позволяют несколько подходов к синтезу производных (действующих как потенциальные ингибиторы), которые сохраняют характер молекулы.
Второй подход к использованию FabD в качестве мишени для лекарственного средства часто упоминается в литературе: FabD может предоставить полезную метку для определения местоположения генов fab, поскольку ген FabD обычно соседствует по крайней мере с одним другим геном fab. Однако (по состоянию на 2015 год) ни одно потенциальное лекарство не пыталось использовать эту функцию.