 | |
| Имена | |
|---|---|
| Другие имена пентафторид тантала | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ECHA InfoCard | 100.029.111 |
| Номер EC |
|
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | TaF 5 |
| Молярная масса | 275,95 г / моль |
| Внешний вид | белый порошок |
| Плотность | 4,74 г / см твердое вещество |
| Точка плавления | 96,8 ° C (206,2 ° F; 369,9 K) |
| Температура кипения | 229,5 ° C (445,1 ° F; 502,6 K) |
| Растворимость в воде | разлагается |
| Магнитная восприимчивость (χ) | + 795,0 · 10 см / моль |
| Структура | |
| Дипольный момент | 0 D |
| Опасности | |
| Основные опасности | HF источник |
| Классификация ЕС (DSD) (устарело) | нет в списке |
| R-фразы (устаревшие) | 34 |
| S-фразы (устаревшие) | 26-27-28-36 / 37 / 39-45 |
| Температура вспышки | Невоспламеняющийся |
| Родственные соединения | |
| Родственные соединения | TaCl 5. NbCl 5. WF6 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии ( при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Фторид тантала (V) является неорганическое соединение с формулой TaF 5. Это одно из основных молекулярных соединений тантала. Это соединение, характерное для некоторых других пентафторидов, является летучим, но существует в виде олигомера в твердом состоянии.
Его получают обработка металлического тантала газообразным фтором . NbF 5 получают аналогично.
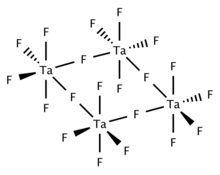
Твердый и расплавленный TaF 5 является тетрамерным, состоящим из четырех центров TaF 6, связанных через мостиковые фторидные центры. Газообразный TaF 5 имеет тригонально-пирамидальную структуру с симметрией D 3h.
Склонность TaF 5 образовывать кластеры в твердом состоянии указывает на льюисову кислотность мономера. Действительно, TaF 5 реагирует с источниками фторида с образованием ионов [TaF. 6]., [TaF. 7]. и [TaF. 8].. С нейтральными основаниями Льюиса, такими как диэтиловый эфир TaF 5 образует аддукты,.
TaF. 5используется в сочетании с HF в качестве катализатора. для алкилирования алканов и алкенов и для протонирования ароматических соединений. Система TaF. 5–HF устойчива в восстановительных средах, в отличие от SbF. 5–HF. В присутствии фторида пентафторид тантала образует анионы [TaF. 8]., [TaF. 7]. или [TaF. 6]., в зависимости от природы противоиона и концентрации HF. Высокие концентрации HF благоприятствуют гексафториду за счет образования HF. 2:
Соли M 3 TaF 8 кристаллизовались. При K = M кристаллы состоят из анионов [TaF. 7]. вместе с фторидом, который не координируется с Ta (V). Для M = M кристаллы имеют [TaF. 8]..
 Сечение структуры Na 3 TaF 8 (Ta = бирюзовый, F = зеленый).
Сечение структуры Na 3 TaF 8 (Ta = бирюзовый, F = зеленый).В процессе Marignac Nb и Ta разделяют фракционной кристаллизацией K2TaF 7 из растворов плавиковой кислоты. В этих условиях ниобий образует K 2 NbOF 5, который более растворим, чем K 2 TaF 7. Восстановление K 2 TaF 7 натрием дает металлический Ta.