 | |
 | |
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Международные названия препаратов |
| Пути введения. | внутривенно |
| код ATCvet | |
| Фармакокинетика | |
| Биодоступность | пренебрежимо малая пероральная биодоступность |
| Метаболизм | выводится в неизмененном виде |
| Элиминация период полувыведения | 6 часов |
| Экскреция | почками |
| Идентификаторы | |
Название IUPAC
| |
| Номер CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL |
|
| CompTox Dashboard (EPA ) | |
| ECHA InfoCard>100,005,589 | |
| Химические и физические данные | |
| Формула | C31H36N2O11 |
| Молярная масса | 612,624 г · моль |
| 3D-модель (JSmol ) | |
SMILES
| |
InChI
| |
Новобиоцин, также известный как альбамицин или катомицин, представляет собой антибиотик аминокумарин, который продуцируется актиномицетом Streptomyces niveus, wh ich недавно был идентифицирован как субъективный синоним S. spheroides, входящего в отряд Actinobacteria. Другие аминокумариновые антибиотики включают хлоробиоцин и кумермицин A1. Впервые о новобиоцине сообщили в середине 1950-х годов (тогда он назывался стрептонивицин ).
Активен против Staphylococcus epidermidis и может использоваться для дифференциации его от других коагулазонегативных Staphylococcus saprophyticus, устойчивый к новобиоцину, в культуре.
Новобиоцин был лицензирован для клинического применения под торговым названием Альбамицин (Pharmacia и Upjohn ) в 1960-е годы. Его эффективность была продемонстрирована в доклинических и клинических испытаниях. С тех пор пероральная форма препарата была снята с рынка из-за отсутствия эффективности.. Новобиоцин - эффективное антистафилококковое средство, используемое для лечения MRSA.
Молекулярная основа действия новобиоцина и других Связанный были исследованы препараты хлоробиоцин и кумермицин A1. Аминокумарины являются очень сильнодействующими ингибиторами бактериальной ДНК-гиразы и действуют, воздействуя на субъединицу GyrB фермента, участвующего в трансдукции энергии. Новобиоцин, а также другие аминокумариновые антибиотики действуют как конкурентные ингибиторы реакции АТФазы, катализируемой GyrB. Эффективность новобиоцина значительно выше, чем у фторхинолонов, которые также нацелены на ДНК-гиразу, но в другом сайте фермента. Субъединица GyrA участвует в активности разрезания и лигирования ДНК.
Было показано, что новобиоцин слабо ингибирует С-конец эукариотического белка Hsp90 (высокий микромолярный IC50). Модификация каркаса новобиоцина привела к более селективным ингибиторам Hsp90. Также было показано, что новобиоцин связывает и активирует грамотрицательный липополисахаридный переносчик LptBFGC.
Новобиоцин представляет собой аминокумарин. Новобиоцин можно разделить на три части; производное бензойной кислоты, остаток кумарина и новобиоза сахара. Рентгеноструктурные исследования показали, что комплекс лекарство-рецептор новобиоцина и ДНК-гиразы показывает, что АТФ и новобиоцин имеют перекрывающиеся участки связывания на гиразе молекула. Перекрытие сайтов связывания кумарина и АТФ согласуется с тем, что аминокумарины являются конкурентными ингибиторами активности АТФазы.
В экспериментах взаимосвязь структурной активности Было обнаружено, что удаление карбамоильной группы, расположенной на новобиозном сахаре, приводит к резкому снижению ингибирующей активности новобиоцина.
Этот аминокумарин Антибиотик состоит из трех основных заместителей. Фрагмент 3-диметилаллил-4-гидроксибензойной кислоты, известный как кольцо A, является производным префената и диметилаллилпирофосфата. Фрагмент аминокумарина, известный как кольцо B, происходит из L -тирозина. Последним компонентом новобиоцина является производное сахара L -новиоза, известное как кольцо C, которое является производным глюкозо-1-фосфата. Кластер биосинтетических генов новобиоцина был идентифицирован Хайде и его сотрудниками в 1999 г. (опубликовано в 2000 г.) из Streptomyces spheroides NCIB 11891. Они идентифицировали 23 предполагаемых открытых рамки считывания (ORF) и более 11 других ORF, которые могут играть роль в биосинтезе новобиоцина.
Биосинтез кольца A (см. фиг. 1 ) начинается с префената, который является производным от пути биосинтеза шикимовой кислоты. Фермент NovF катализирует декарбоксилирование префената, одновременно восстанавливая никотинамидадениндинуклеотидфосфат (НАДФ) с образованием НАДФН. После этого NovQ катализирует электрофильное замещение фенильного кольца диметилаллилпирофосфатом (DMAPP), иначе известное как пренилирование. DMAPP может поступать либо по пути мевалоновой кислоты, либо по пути биосинтеза дезоксиксилулозы. Затем молекула 3-диметилаллил-4-гидроксибензоата подвергается двум окислительным декарбоксилированием под действием NovR и молекулярного кислорода. NovR - негемовая железооксигеназа с уникальным бифункциональным катализом. На первом этапе оба атома кислорода включаются из молекулярного кислорода, тогда как на втором этапе вводится только один атом, как это определено исследованиями по мечению изотопов. Это завершает образование кольца A.
 Рис. 1. Схема биосинтеза бензамидной части новобиоцина (4-гидрокси-3- (3-метилбут-2-ен-1-ил) бензойная кислота)
Рис. 1. Схема биосинтеза бензамидной части новобиоцина (4-гидрокси-3- (3-метилбут-2-ен-1-ил) бензойная кислота) Биосинтез кольца B (см. рис. 2 ) начинается с природной аминокислоты L-тирозин. Затем он аденилируется и тиоэтерифицируется на пептидильный белок-носитель (PCP) NovH с помощью ATP и самого NovH. Затем NovI модифицирует эту связанную молекулу PCP, окисляя β-положение, используя НАДФН и молекулярный кислород. NovJ и NovK образуют гетеродимер J2K2, который является активной формой этой бензилоксигеназы. В этом процессе НАДФ используется в качестве акцептора гидрида при окислении β-спирта. Этот кетон предпочтет существовать в виде енольного таутомера в растворе. Затем еще не идентифицированный белок катализирует селективное окисление бензола (как показано на рис. 2). При окислении этот промежуточный продукт самопроизвольно лактонизируется с образованием ароматического кольца B и теряет NovH в процессе.
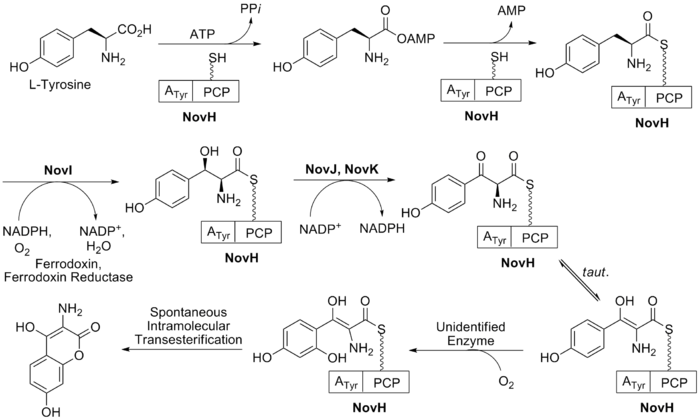 Рис. 2. Биосинтез 3-амино-4,7-дигидрокси-2H-хромен-2-она компонента новобиоцина (кольцо B)
Рис. 2. Биосинтез 3-амино-4,7-дигидрокси-2H-хромен-2-она компонента новобиоцина (кольцо B)Биосинтез L -новиозы (кольцо C) показан на рис. 3 . Этот процесс начинается с глюкозо-1-фосфата, где NovV принимает dTTP и заменяет фосфатную группу на группу dTDP. NovT затем окисляет 4-гидроксигруппу с помощью NAD. NovT также выполняет дегидроксилирование в положении 6 сахара. NovW затем эпимеризует положение 3 сахара. Метилирование в положении 5 осуществляется с помощью NovU и S-аденозилметионина (SAM). Наконец, NovS снижает положение 4 снова для достижения эпимеризации этого положения из исходного глюкозо-1-фосфата с использованием NADH.
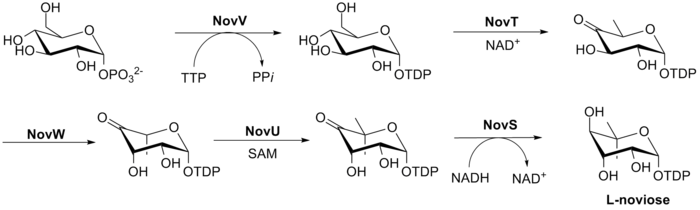 Рисунок 3. Биосинтез L-новиозного компонента новобиоцина (кольцо C)
Рисунок 3. Биосинтез L-новиозного компонента новобиоцина (кольцо C)Кольца A, B, и C соединяются вместе и модифицируются с получением готовой молекулы новобиоцина. Кольца A и B соединяются вместе ферментом NovL с использованием АТФ для дифосфорилирования карбоксилатной группы o f кольцо A, так что карбонил может подвергаться атаке аминогруппы в кольце B. Полученное соединение метилируют NovO и SAM перед гликозилированием. NovM добавляет кольцо C (L -новиоза) к гидроксильной группе, полученной из тирозина, с потерей dTDP. Другое метилирование осуществляется NovP и SAM в положении 4 L -новиозного сахара. Это метилирование позволяет NovN карбамилировать 3-е положение сахара, как показано на рис. 4 завершение биосинтеза новобиоцина.
 Рисунок 4. Завершенный биосинтез новобиоцина из кольцевых систем A, Bи C.
Рисунок 4. Завершенный биосинтез новобиоцина из кольцевых систем A, Bи C.