| Белок деления клеток FtsZ | |
|---|---|
| Идентификаторы | |
| Условное обозначение | FtsZ |
| ИнтерПро | IPR000158 |
| CATH | 1fsz |
| SCOP2 | 1fsz / SCOPe / SUPFAM |
| CDD | cd02201 |
| FtsZ, C-терминал сэндвич | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Условное обозначение | FtsZ_C | ||||||||
| Pfam | PF12327 | ||||||||
| ИнтерПро | IPR024757 | ||||||||
| |||||||||
| Белок деления клеток FtsZ | |||||||
|---|---|---|---|---|---|---|---|
 Молекулярная структура FtsZ (PDB 1fsz). Молекулярная структура FtsZ (PDB 1fsz). | |||||||
| Идентификаторы | |||||||
| Организм | кишечная палочка | ||||||
| Условное обозначение | ftsZ | ||||||
| UniProt | P0A9A6 | ||||||
| |||||||
FtsZ - это белок, кодируемый геном ftsZ , который собирается в кольцо в месте будущего деления бактериальной клетки (также называемое кольцом Z). FtsZ является прокариотическим гомологом из эукариотического белка тубулина. Инициалы FtsZ среднее " F ilamenting т emperature- с ensitive мутантный Z ". Гипотеза заключалась в том, что мутанты клеточного деления E. coli будут расти в виде нитей. из-за неспособности дочерних клеток отделяться друг от друга. FtsZ содержится почти во всех бактериях, многих архее, всех хлоропластах и некоторых митохондриях, где он необходим для деления клеток. FtsZ собирает цитоскелетный каркас Z-кольца, которое вместе с дополнительными белками сжимается, чтобы разделить клетку на две части.
В 1960-х годах ученые провели скрининг на чувствительные к температуре мутации, блокирующие деление клеток при 42 ° C. Мутантные клетки нормально делились при 30 °, но не делились при 42 °. Непрерывный рост производства без разделения длинные нитевидные клетки ( F ilamenting т емпера тура с ensitive). Несколько таких мутантов были обнаружены и сопоставлены с локусом, первоначально названным ftsA, который мог быть одним или несколькими генами. В 1980 году Люткенхаус и Доначи показали, что несколько из этих мутаций картированы в одном гене, ftsA, но один хорошо охарактеризованный мутант, PAT84, первоначально обнаруженный Хиротой и др., Картирован в отдельном соседнем гене. Они назвали этот ген клеточного деления ftsZ. В 1991 году Би и Люткенхаус использовали электронную микроскопию иммунного золота, чтобы показать, что FtsZ локализуется на инвагинирующей перегородке в средней клетке. Впоследствии группы Losick и Margolin использовали иммунофлуоресцентную микроскопию и слияния GFP, чтобы показать, что FtsZ собирает Z-кольца на ранних этапах клеточного цикла, задолго до того, как перегородка начинает сжиматься. Затем другие белки деления собираются на Z-кольцо, и сжатие происходит в последней части клеточного цикла.
В 1992–1993 годах три лаборатории независимо друг от друга обнаружили, что FtsZ был связан с эукариотическим тубулином, который представляет собой белковую субъединицу, которая собирается в микротрубочки. Это было первое открытие, что у бактерий есть гомологи белков цитоскелета эукариот. Более поздние исследования показали, что FtsZ присутствует и необходим для деления клеток почти всех бактерий и многих, но не всех архей.
Митохондрии и хлоропласты - это эукариотические органеллы, возникшие как бактериальные эндосимбионты, поэтому был большой интерес к тому, используют ли они FtsZ для деления. Хлоропласт FtsZ был впервые обнаружен Остериунгом, и теперь известно, что все хлоропласты используют FtsZ для деления. Митохондриальный FtsZ был обнаружен Бук в водоросли; FtsZ используется для деления митохондрий у некоторых эукариот, в то время как другие заменили его механизмом на основе динамина.
 Ингибирование FtsZ нарушает образование перегородки, что приводит к филаментации бактериальных клеток (вверху справа на электронной микрофотографии).
Ингибирование FtsZ нарушает образование перегородки, что приводит к филаментации бактериальных клеток (вверху справа на электронной микрофотографии). Во время деления клетки FtsZ является первым белком, который перемещается к месту деления, и необходим для набора других белков, которые производят новую клеточную стенку ( перегородку ) между делящимися клетками. Роль FtsZ в делении клеток аналогична тубулина в эукариотической деление клеток, но, в отличие от актина - миозина кольца в эукариот, FtsZ не известный белок двигателя, связанный с ним. Таким образом, происхождение цитокинетической силы остается неясным, но считается, что локальный синтез новой клеточной стенки производит по крайней мере часть этой силы. В липосомах Osawa (2009) показал, что FtsZ способен проявлять сократительную силу без присутствия других белков.
Эриксон (2009) предположил, как роль тубулиноподобных белков и актиноподобных белков в делении клеток стала обратной в эволюционной загадке. Использование кольца FtsZ для деления хлоропластов и некоторых митохондрий дополнительно подтверждает их прокариотическое происхождение. Бактерии L-формы, у которых отсутствует клеточная стенка, не нуждаются в FtsZ для деления, что означает, что бактерии могли сохранить компоненты предкового способа деления клеток.
Много известно о динамической полимеризационной активности тубулина и микротрубочек, но мало известно об этой активности в FtsZ. Хотя известно, что одноцепочечные протофиламенты тубулина образуют 13-нитевые микротрубочки, многоцепочечная структура Z-кольца, содержащего FtsZ, неизвестна. Это только предположение, что структура состоит из перекрывающихся протофиламентов. Тем не менее, недавняя работа с очищенным FtsZ на поддерживаемых липидных бислоях, а также визуализация FtsZ в живых бактериальных клетках показали, что протофиламенты FtsZ имеют полярность и движутся в одном направлении с помощью беговой дорожки (см. Также ниже).
Недавно белки, подобные тубулину и FtsZ, были обнаружены в больших плазмидах, обнаруженных у видов Bacillus. Считается, что они функционируют как компоненты сегросом, которые представляют собой мультибелковые комплексы, которые разделяют хромосомы / плазмиды у бактерий. Плазмидные гомологи тубулина / FtsZ, по-видимому, сохранили способность полимеризоваться в филаменты.
 Z-кольцо образуется из более мелких субъединиц волокон FtsZ. Эти нити могут натягиваться друг на друга и сжиматься, чтобы разделить клетку.
Z-кольцо образуется из более мелких субъединиц волокон FtsZ. Эти нити могут натягиваться друг на друга и сжиматься, чтобы разделить клетку. 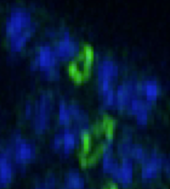 Изображение Z-колец в сверхвысоком разрешении (зеленые) на разных стадиях сжатия в двух клетках E. coli.
Изображение Z-колец в сверхвысоком разрешении (зеленые) на разных стадиях сжатия в двух клетках E. coli. FtsZ обладает способностью связываться с GTP, а также демонстрирует домен GTPase, который позволяет ему гидролизовать GTP до GDP и фосфатной группы. In vivo FtsZ формирует филаменты с повторяющимся расположением субъединиц, все они расположены голова к хвосту. Эти нити образуют кольцо вокруг продольной средней точки или перегородки клетки. Это кольцо называется Z-кольцом.
ГТФ-гидролизирующая активность белка не важна для образования нитей или деления клеток. Мутанты, дефектные по активности GTPase, часто все же делятся, но иногда образуют скрученные и неупорядоченные перегородки. Неясно, действительно ли FtsZ обеспечивает физическую силу, которая приводит к делению, или служит маркером для других белков, выполняющих деление.
Если FtsZ действительно обеспечивает силу, которая разделяет клетку, это может происходить за счет относительного движения субъединиц. Компьютерные модели и измерения in vivo показывают, что одиночные филаменты FtsZ не могут выдерживать длину более 30 субъединиц. В этой модели сила разрыва FtsZ возникает из-за относительного бокового движения субъединиц. Линии FtsZ будут выстраиваться параллельно и натягивать друг друга, образуя «шнур» из множества струн, который сам стягивается.
В других моделях FtsZ не обеспечивает сократительную силу, но предоставляет клетке пространственный каркас для других белков, чтобы выполнять деление клетки. Это сродни созданию строителями временной конструкции для доступа в труднодоступные места здания. Временная структура обеспечивает беспрепятственный доступ и гарантирует, что рабочие могут добраться до любого места. Если временное сооружение построено неправильно, рабочие не смогут добраться до определенных мест, и здание будет неполноценным.
Теория каркаса подтверждается информацией, которая показывает, что образование кольца и его локализация на мембране требует согласованного действия ряда дополнительных белков. ZipA или FtsA, гомолог актина, допускают начальную локализацию FtsZ на мембране. После локализации на мембране белки деления семейства Fts рекрутируются для сборки кольца. Многие из этих белков направляют синтез новой перегородки деления в средней клетке (FtsI, FtsW) или регулируют активность этого синтеза (FtsQ, FtsL, FtsB, FtsN). Время образования Z-кольца предполагает возможность пространственного или временного сигнала, который позволяет формировать волокна FtsZ.
Недавняя визуализация в сверхвысоком разрешении у нескольких видов животных поддерживает динамическую модель каркаса, в которой небольшие кластеры протофиламентов FtsZ или пучков протофиламентов перемещаются в одном направлении по окружности кольца посредством беговой дорожки, прикрепленных к мембране с помощью FtsA и других FtsZ-специфичных мембранных страховочных тросов. Скорость беговой дорожки зависит от скорости гидролиза GTP в протофиламентах FtsZ, но у Escherichia coli синтез перегородки деления остается этапом, ограничивающим скорость цитокинеза. Беговое действие FtsZ необходимо для правильного синтеза перегородки деления с помощью ферментов синтеза пептидогликана перегородки, что позволяет предположить, что эти ферменты могут отслеживать растущие концы нитей.
Формирование Z-кольца полностью совпадает с клеточными процессами, связанными с репликацией. Образование Z-кольца совпадает с прекращением репликации генома у E. coli и 70% хромосомной репликации у B. subtilis. Время образования Z-кольца предполагает возможность пространственного или временного сигнала, который позволяет формировать волокна FtsZ. В Escherichia coli, по крайней мере, два негативных регулятора сборки FtsZ образуют биполярный градиент, так что критическая концентрация FtsZ, необходимая для сборки FtsZ, является самой низкой в средней клетке между двумя сегрегационными хромосомами. Этот тип регуляции, по-видимому, встречается у других видов, таких как Bacillus subtilis и Caulobacter crescentus. Однако другие виды, включая Streptococcus pneumoniae и Myxococcus xanthus, по- видимому, используют положительные регуляторы, которые стимулируют сборку FtsZ в средней клетке.
Полимеризация FtsZ также связана со стрессорами, такими как повреждение ДНК. Повреждение ДНК вызывает производство множества белков, один из которых называется SulA. SulA предотвращает полимеризацию и ГТФазную активность FtsZ. SulA выполняет эту задачу путем привязки к самопознавающимся сайтам FtsZ. Изолируя FtsZ, клетка может напрямую связывать повреждение ДНК с ингибированием деления клетки.
Как и SulA, существуют другие механизмы, предотвращающие деление клеток, которое может привести к нарушению передачи генетической информации дочерним клеткам. К настоящему времени в E. coli и B. subtilis были идентифицированы два белка, которые предотвращают деление по области нуклеоида: Noc и SlmA. Нокауты гена Noc приводят к клеткам, которые делятся независимо от области нуклеоида, что приводит к его асимметричному разделению между дочерними клетками. Механизм не совсем понятен, но предполагается, что он связан с секвестрацией FtsZ, предотвращающей полимеризацию в области нуклеоида. Механизм, используемый SlmA для ингибирования полимеризации FtsZ над нуклеоидом, лучше понят и использует две отдельные стадии. Один домен SlmA связывается с полимером FtsZ, затем отдельный домен SlmA разделяет полимер. Полагают, что аналогичный механизм используется MinC, другим ингибитором полимеризации FtsZ, участвующим в позиционировании кольца FtsZ.
Число штаммов бактерий с множественной лекарственной устойчивостью в настоящее время увеличивается; Таким образом, срочно необходимо определение целевых лекарств для разработки новых противомикробных препаратов. Потенциальная роль FtsZ в блокировании клеточного деления, вместе с его высокой степенью консервативности среди видов бактерий, делает FtsZ очень привлекательной мишенью для разработки новых антибиотиков. Исследователи работают над синтетическими молекулами и натуральными продуктами в качестве ингибиторов FtsZ.