| Домен C2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
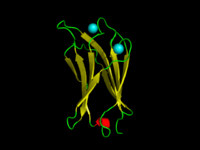 Домен C2 α-токсина C.absonum (PDB 1OLP). β-тяжи показаны желтым, α-спирали - красным, петли - зеленым. Скоординированные ионы кальция имеют голубой цвет. Домен C2 α-токсина C.absonum (PDB 1OLP). β-тяжи показаны желтым, α-спирали - красным, петли - зеленым. Скоординированные ионы кальция имеют голубой цвет. | |||||||||
| Идентификаторы | |||||||||
| Символ | C2 | ||||||||
| Pfam | PF00168 | ||||||||
| InterPro | IPR000008 | ||||||||
| SMART | C2 | ||||||||
| PROSITE | PDOC00380 | ||||||||
| SCOPe | 1qas / SUPFAM | ||||||||
| суперсемейство OPM | 45 | ||||||||
| белок OPM | 1ugk | ||||||||
| CDD | cd00030 | ||||||||
| |||||||||
| Фосфоинозитид-3-киназа C2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
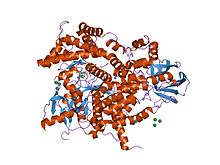 Структура фосфоинозитид-3-киназы. Структура фосфоинозитид-3-киназы. | |||||||||||
| Идентификаторы | |||||||||||
| Символ | PI3K_C2 | ||||||||||
| Pfam | PF00792 | ||||||||||
| InterPro | IPR002420 | ||||||||||
| SMART | PI3K_C2 | ||||||||||
| PROSITE | PDOC50004 | ||||||||||
| SCOPe | 1e8x / SUPFAM | ||||||||||
| CDD | cd08380 | ||||||||||
| |||||||||||
A домен C2 представляет собой белок структурный домен, участвующий в нацеливании белков на клеточные мембраны. Типичная версия (PKC-C2) имеет бета-сэндвич, состоящий из 8 β-нитей, который координирует два или три иона кальция, которые связываются полость, образованная первой и последней петлями домена на поверхности связывания мембраны. Многие другие семейства доменов C2 не обладают активностью связывания кальция.
Домены C2 часто обнаруживаются связанными с ферментативными доменами; например, домен C2 в PTEN приводит домен фосфатазы в контакт с плазматической мембраной, где он может дефосфорилировать свой субстрат, фосфатидилинозит (3,4,5) -трисфосфат (PIP 3), не удаляя его с мембраны - что было бы очень затратно с точки зрения энергетики. PTEN состоит из двух доменов, домена протеинтирозинфосфатазы и домена C2. Эта пара доменов составляет супердомен, наследуемая единица, которая содержится в различных белках грибов, растений и животных. Кроме того, фосфатидилинозитол-3-киназа (PI3-киназа), фермент, фосфорилирующий фосфоинозитиды на 3-гидроксильной группе кольца инозита также использует домен C2 для связывания с мембраной (например, запись PDB 1e8w).
Домен C2 в настоящее время известен только у эукариот и прокариотов Clostridium perfringens, где он является частью альфа-токсина. Более 17 различных кладов доменов C2 были идентифицированы. Большинство семейств C2 можно проследить до основных видов эукариот, что указывает на раннюю диверсификацию до последнего общего предка эукариот (LECA). Только семейство доменов PKC-C2 содержит консервативные кальций-связывающие остатки, предполагая, что типичное кальций-зависимое мембранное взаимодействие является производным признаком, ограниченным доменами PKC-C2.
C2 домены уникальны среди доменов, нацеленных на мембрану, в том, что они демонстрируют широкий диапазон липидной селективности в отношении основных компонентов клеточных мембран, включая фосфатидилсерин и фосфатидилхолин. Этот домен C2 состоит примерно из 116 аминокислотных остатков и расположен между двумя копиями домена C1 в протеинкиназе C (которые связывают сложные эфиры форбола и диацилглицерин) (см. PDOC00379 ) и каталитическим доменом протеинкиназы ( см. PDOC00100 ). Области со значительной гомологией с C2-доменом были обнаружены во многих белках. Считается, что домен C2 участвует в кальций-зависимом связывании фосфолипидов и в процессах нацеливания на мембрану, таких как субклеточная локализация. Хотя большинство доменов C2 взаимодействуют с мембраной (фосфолипиды) Ca-зависимым образом, некоторые домены C2 могут взаимодействовать с мембраной без связывания с Ca. Сходным образом, C2-домены имеют различную специфичность для липидов. Многие домены C2, такие как синаптотагмин C2A, связываются с анионными фосфолипидами (PS или PIP2, содержащими фосфолипиды). Однако другие домены C2, такие как домен C2 cPLA2-α, связываются с цвиттерионными липидами (например, PC). Такое разнообразие и избирательность в связывании Са и липидов предполагает, что домены C2 эволюционировали, чтобы иметь разные функции.
Домен образует восьмицепочечный бета-сэндвич, построенный вокруг консервативной четырехцепочечной мотив, обозначенный клавишей C2. Кальций связывается в чашеобразном углублении, образованном N- и C-концевыми петлями C2-ключевого мотива. Структурный анализ нескольких доменов C2 показал, что они состоят из сходных тройных структур, в которых три Са-связывающие петли расположены на конце 8-ми нитевого антипараллельного бета-сэндвича.
; BAIAP3 ; BCR ; ; ; САПР ; CADPS2 ; CAPN5 ; CAPN6 ; CC2D1A ; ; CPNE1 ; ; ; CPNE4 ; ; CPNE6 ; ; CPNE8 ; ; DAB2IP ; DOC2A ; DOC2B ; DYSF ; ESYT1 ; ; FAM62A ; FAM62B ; ; FER1L3 ; ; HECW1 ; HECW2 ; ITCH ; ITSN1 ; ITSN2 ; ; ; ; NEDD4 ; NEDD4L ; ; OTOF ; PCLO ; PIK3C2A ; PIK3C2B ; PIK3C2G ; PLA2G4A ; PLA2G4B ; ; ; ; PLCB1 ; PLCB2 ; PLCB3 ; PLCB4 ; PLCD1 ; PLCD3 ; PLCD4 ; PLCE1 ; PLCG1 ; PLCG2 ; ; ; ; ; ; PRF1 ; ; PRKCB1 ; PRKCE ; PRKCG ; ПРКЧ ; RAB11FIP1 ; RAB11FIP2 ; RAB11FIP5 ; RASA1 ; ; RASA3 ; RASA4 ; ; RASAL2 ; RGS3 ; RIMS1 ; RIMS2 ; ; ; RPGRIP1 ; RPGRIP1L ; RPH3A ; ; SMURF1 ; SMURF2 ; SYNGAP1 ; SYT1 ; ; SYT11 ; ; SYT13 ; SYT14 ; ; ; ; ; SYT2 ; SYT3 ; SYT4 ; SYT5 ; SYT6 ; SYT7 ; ; SYT9 ; SYTL1 ; SYTL2 ; ; SYTL4 ; ; TOLLIP ; UNC13A ; UNC13B ; ; UNC13D ; WWC2 ; WWP1 ; WWP2 ; PTEN