A 3D-культура клеток - это искусственно созданная среда, в которой биологические клеткам разрешено расти или взаимодействовать со своим окружением во всех трех измерениях. В отличие от 2D-среды (например, чашки Петри ), 3D-культура клеток позволяет клеткам in vitro расти во всех направлениях, подобно тому, как они in vivo. Эти трехмерные культуры обычно выращивают в биореакторах, небольших капсулах, в которых клетки могут расти в сфероиды, или в трехмерные клеточные колонии. Приблизительно 300 сфероидов обычно культивируют в одном биореакторе.
3D-культуры клеток используются в исследованиях в течение нескольких десятилетий. Один из первых зарегистрированных подходов к их разработке был сделан в начале 20 века, когда Алексис Каррел попытался разработать методы для пролонгированных культур тканей in vitro. Ранние исследования 80-х, проведенные Миной Биссел из Национальной лаборатории Лоуренса Беркли, подчеркнули важность 3D-методов для создания точных моделей культивирования in vitro. Эта работа была сосредоточена на важности внеклеточного матрикса и способности культур в искусственных трехмерных матрицах производить физиологически значимые многоклеточные структуры, такие как ацинарные структуры в моделях здоровой и раковой ткани груди. Эти методы применялись в моделях заболеваний in vitro, используемых для оценки клеточных ответов на фармацевтические соединения.
Эрик Саймон в отчете о гранте NIH SBIR 1988 года показал, что Electrospinning может использоваться для производила нано- и субмикронные полистирольные и поликарбонатные волокнистые маты (теперь известные как каркасы), специально предназначенные для использования в качестве субстратов для клеток in vitro. Это раннее использование электроспряденных фиброзных решеток для клеточных культур и тканевой инженерии показало, что различные типы клеток, включая фибробласты крайней плоти человека (HFF), трансформированную карциному человека (HEp-2) и эпителий легких норки (MLE), будут прилипать к волокнам и размножаться на них.. Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на электропряденых волокнах, демонстрируют более гистотипную округлую трехмерную морфологию, обычно наблюдаемую in vivo.
В В живой ткани клетки существуют в трехмерных микросредах со сложными межклеточными и межклеточными взаимодействиями и сложной динамикой транспорта питательных веществ и клеток. Стандартные 2D или однослойные клеточные культуры неадекватно отражают эту среду, что часто делает их ненадежными предикторами in vivo эффективности и токсичности лекарственного средства. Трехмерные сфероиды больше напоминают ткань in vivo с точки зрения клеточной коммуникации и развития внеклеточных матриц. Эти матрицы помогают клеткам двигаться внутри своего сфероида подобно тому, как клетки движутся в живой ткани. Таким образом, сфероиды являются улучшенными моделями миграции клеток, дифференцировки, выживания и роста. Кроме того, 3D-культуры клеток обеспечивают более точное изображение поляризации клеток, поскольку в 2D клетки могут быть поляризованы только частично. Более того, клетки, выращенные в 3D, демонстрируют иную экспрессию генов, чем клетки, выращенные в 2D.
Третье измерение роста клеток обеспечивает больше контактного пространства для механических воздействий и для клеточной адгезии, который необходим для лигирования интегрина, сокращения клеток и даже внутриклеточной передачи сигналов. Нормальная диффузия растворенного вещества и связывание с эффекторными белками (такими как факторы роста и ферменты ) также зависят от трехмерного клеточного матрикса, поэтому он имеет решающее значение для установления градиентов концентрации растворенного вещества в масштабе ткани
Для целей скрининга лекарств токсикологии гораздо полезнее тестировать экспрессию генов клеток in vitro, выращенных в 3D, чем в 2D, так как экспрессия генов в 3D сфероидах будет более близка экспрессия генов in vivo. Наконец, 3D-культуры клеток обладают большей стабильностью и большей продолжительностью жизни, чем культуры клеток в 2D. Это означает, что они больше подходят для длительных исследований и для демонстрации долгосрочных эффектов препарата. Трехмерная среда также позволяет клеткам беспрепятственно расти. В 2D клетки должны подвергаться регулярной трипсинизации, чтобы обеспечить их достаточным количеством питательных веществ для нормального роста клеток. 3D-сфероиды культивировались в лабораторных условиях в течение 302 дней, при этом поддерживая здоровый, незлокачественный рост.
Существует большое количество коммерчески доступных культиваторов. инструменты, которые утверждают, что предоставляют преимущества 3D-культуры клеток. В целом, платформы можно разделить на два типа методов 3D-культивирования: методы каркаса и методы без каркаса .
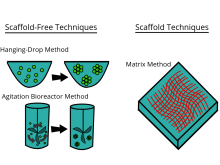 Модель, показывающая три примера методов, используемых для культивирования клеток в трехмерной среде.
Модель, показывающая три примера методов, используемых для культивирования клеток в трехмерной среде. Технологии каркаса включают использование твердых каркасов, гидрогелей и других материалов. В недавнем исследовании потенциальные возможности человеческих CD34 + стволовых клеток изучались путем создания трехмерной модели геля агарозы in vitro для понимания процесса оссификации костей.
В качестве естественного внеклеточного матрикса (ECM) важен для выживания, пролиферации, дифференцировки и миграции клеток, различные гидрогелевые матрицы, имитирующие естественную структуру ECM, рассматриваются как потенциальные подходы к культивированию клеток, подобному in vivo. Гидрогели состоят из взаимосвязанных пор с высоким удержанием воды, что позволяет эффективно транспортировать, например, питательные вещества и газы. Для трехмерной клеточной культуры доступно несколько различных типов гидрогелей из природных и синтетических материалов, в том числе, например, гидрогели экстрактов ЕСМ животных, белковые гидрогели, пептидные гидрогели, полимерные гидрогели и наноцеллюлозный гидрогель на основе древесины.
В методах без каркасов используется другой подход, независимый от использования каркаса. Методы без каркасов включают, например, использование пластин с низкой адгезией, пластин с висячими каплями, поверхностей с микрорельефами и вращающихся биореакторов, магнитной левитации и магнитной 3D-биопечати.
 Электронная микроскопия сфероид мезотелиомы (NCI-H226). Масштабные линейки, 200 мкм.
Электронная микроскопия сфероид мезотелиомы (NCI-H226). Масштабные линейки, 200 мкм. Сфероиды - это тип трехмерного моделирования клеток, который лучше имитирует условия окружающей среды живой клетки по сравнению с двухмерной клеточной моделью, особенно с реакциями между клетками и реакциями между клетками и матрицей.. Сфероиды полезны при изучении изменения физиологических характеристик клеток, различий в структуре здоровых клеток и опухолевых клеток, а также изменений, которым подвергаются клетки при формировании опухоли. Сфероиды, культивированные совместно с опухолевыми и здоровыми клетками, использовались для моделирования того, как раковые клетки взаимодействуют с нормальными клетками. Сфероиды можно выращивать несколькими разными методами. Одним из распространенных методов является использование планшетов с низкой адгезией клеток, обычно 96-луночных планшетов, для массового производства сфероидных культур, где агрегаты образуются на закругленном дне планшетов с клетками. Сфероиды также можно культивировать с использованием метода висящих капель, включающего формирование клеточных агрегатов в каплях, которые свисают с поверхности клеточной пластинки. Другие исследуемые методы включают использование биореакторов с вращающимися стенками сосудов, которые вращают и культивируют клетки, когда они постоянно находятся в свободном падении, и формируют агрегаты слоями. В последнее время некоторые протоколы были стандартизированы для получения однородных и надежных сфероидов.
Биореакторы, используемые для трехмерных культур клеток, представляют собой небольшие пластиковые цилиндрические камеры, специально разработанные для роста клеток в трех измерениях. В биореакторе используются биоактивные синтетические материалы, такие как полиэтилентерефталатные мембраны, для окружения сфероидных клеток в среде, которая поддерживает высокие уровни питательных веществ. Их легко открывать и закрывать, поэтому клеточные сфероиды можно удалить для тестирования, но при этом камера способна поддерживать 100% влажность. Эта влажность важна для достижения максимального роста и функционирования клеток. Камера биореактора является частью более крупного устройства, которое вращается для обеспечения равного роста клеток в каждом направлении в трех измерениях.. MC2 Biotek разработала биореактор для инкубации прототкани, в котором используется газообмен для поддержания высокого уровня. уровни кислорода в камере ячейки. Это улучшение по сравнению с предыдущими биореакторами, потому что более высокий уровень кислорода помогает клеткам расти и проходить нормальное клеточное дыхание.
Различные клеточные структуры в организме человека должны быть васкуляризированы получать питательные вещества и газообмен, чтобы помочь им выжить. Точно так же трехмерные культуры клеток in vitro требуют определенного уровня циркуляции жидкости, что может быть проблематичным для плотных трехмерных культур, где не все клетки могут иметь адекватное воздействие питательных веществ. Это особенно важно в культурах гепатоцитов, потому что печень является сильно васкуляризованным органом. В одном исследовании культивировали гепатоциты и сосудистые клетки вместе на гелевом каркасе коллаген между микрофлюидными каналами, и сравнивали рост клеток в статической и проточной средах и показали необходимость в моделях с тканями и микрососудистая сеть.
Продвинутая разработка 3D-моделей для высокопроизводительного скрининга в форматах с высокой плотностью недавно стала возможной благодаря технологическим достижениям, связанным с увеличением микропланшет плотность. Их можно найти в 384- и 1536-луночных форматах, которые отталкивают клетки, экономичны и подходят для полностью автоматизированных платформ скрининга. Два варианта, которые обеспечивают 1536-луночные форматы, доступны либо от Greiner Bio-One с использованием m3D Magnetic 3D bioprinting, и от Corning Life Sciences, которое включает в себя сверхнизкое покрытие поверхности прикрепления, а также геометрию микрополости и силу тяжести для создавать 3D модели. Благодаря быстрым и доступным методам и технологиям, которые были разработаны для трехмерного скрининга, стали возможны параллельные высокопроизводительные подходы к скринингу для проверки изогенных пар связанных с онкогеном мутантов по сравнению с диким типом.
Основная цель выращивания клеток в трехмерных каркасах и в виде трехмерных клеточных сфероидов in vitro состоит в том, чтобы проверить фармакокинетические и фармакодинамические эффекты лекарств и наноматериалов в доклинических испытаниях. Исследования токсикологии показали 3D культуры клеток должны быть почти на одном уровне с исследованиями in vivo в целях тестирования токсичности лекарственных соединений. При сравнении значений LD50 для 6 распространенных препаратов: ацетаминофен, амиодарон, диклофенак, метформин, фенформина и вальпроевая кислота, значения трехмерного сфероида напрямую коррелировали с данными исследований in vivo. Хотя 2D-культуры клеток ранее использовались для тестирования токсичности наряду с исследованиями in vivo, 3D-сфероиды лучше подходят для тестирования токсичности при хроническом воздействии из-за их более длительной продолжительности жизни. Матрица в трехмерных сфероидах заставляет клетки поддерживать актиновые филаменты и физиологически более релевантна для организации цитоскелета, полярности и формы клеток человека. Трехмерная компоновка позволяет культурам создавать модель, которая более точно напоминает человеческую ткань in vivo без использования подопытных животных.
Существующие 3D-методы не лишены ограничений, включая масштабируемость, воспроизводимость, чувствительность и совместимость с приборами для высокопроизводительного скрининга (HTS). HTS на основе клеток основывается на быстром определении клеточного ответа на взаимодействие с лекарствами, такого как дозозависимая жизнеспособность клеток, взаимодействие клетка-клетка / клетка-матрица и / или миграция клеток, но доступные анализы не оптимизированы для трехмерного культивирования клеток. Еще одна проблема, с которой сталкивается трехмерное культивирование клеток, - это ограниченное количество данных и публикаций, в которых рассматриваются механизмы и корреляции взаимодействия лекарств, дифференцировки клеток и передачи сигналов в этих трехмерных средах. Ни один из 3D-методов еще не заменил 2D-культивирование в больших масштабах, в том числе в процессе разработки лекарств ; хотя количество публикаций о трехмерном культивировании клеток быстро растет, текущая ограниченная биохимическая характеристика трехмерной ткани снижает принятие новых методов.
Существуют также проблемы с использованием сфероидов в качестве модели раковой ткани. Несмотря на то, что опухолевые сфероиды полезны для трехмерной культуры тканей, их критикуют за то, что они затрудняют или невозможно «манипулировать градиентами растворимых молекул в конструкциях [трехмерный сфероид] и охарактеризовать клетки в этих сложных градиентах», в отличие от трехмерной клеточной культуры на бумажной основе для биотесты на основе тканей, исследованные Ratmir et al. Дополнительные проблемы, связанные со сложными методами трехмерного культивирования клеток, включают: получение изображений из-за большого размера каркаса и несовместимости со многими флуоресцентными микроскопами, проточную цитометрию, поскольку она требует диссоциации сфероидов в одноклеточную суспензию и автоматизацию работы с жидкостью.