Тиофосфаты (или фосфоротиоаты, PS): химические соединения и анионы с общей химической формулой PS. 4-x O. x(x = 0, 1, 2 или 3) и родственные производные, в которых органические группы присоединены к одной или нескольким O или S. Тиофосфаты содержат тетраэдрические центры фосфора (V).
Органотиофосфаты представляют собой подкласс фосфорорганических соединений, структурно связанных с неорганическими тиофосфатами. Общие члены имеют формулы типа (RO) 3-x RxPS и родственные соединения, где RO заменен на RS. Многие из этих соединений используются в качестве инсектицидов, некоторые имеют медицинское применение, а некоторые используются в качестве масляных добавок.

диалкилдитиофосфат цинка, масляная добавка.

Фосфоротиоаты - основа антисмысловой терапии.

Амифостин, который используется в химиотерапии рака.
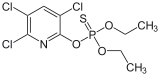
Хлорпирифос, популярный инсектицид.
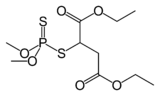
Малатион, популярный инсектицид.
Фосфоротиоаты олигонуклеотидов (OPS) представляют собой модифицированные олигонуклеотиды, в которых один из атомов кислорода в фосфатном фрагменте заменен на серу. Они составляют основу антисмысловой терапии, например, препараты фомивирсен (витравен), облимерсен, аликафорсен и мипомерсен. (Kynamro).
 Структуры выбранных тиофосфатов.
Структуры выбранных тиофосфатов. Простейшие тиофосфаты имеют формулу [PS 4 − x Ox]. Эти трианионы наблюдаются только при очень высоких pH, вместо этого они существуют в протонированной форме с формулой [H nPS4-x Ox] (x = 0, 1, 2 или 3 и (n = 1, 2, или 3).
 Шаровидная модель гипотетического трианиона монотиофосфата.
Шаровидная модель гипотетического трианиона монотиофосфата. Монотиофосфат - это анион [PO 3 S], который имеет C 3vсимметрия. Поваренная соль - монотиофосфат натрия (Na 3PO3S). Монотиофосфат используется в исследованиях как аналог фосфата в биохимии. Эфиры монотиофосфата являются биохимическими реагенты, используемые в исследовании транскрипции, анализах взаимовлияния замещения. Иногда «монотиофосфат» относится к сложным эфирам, таким как (CH 3O)2POS.
Дитиофосфат имеет формулу [PO 2S2], который имеет симметрию C 2v. Дитиофосфат натрия, который является бесцветным, является основным продуктом реакции фосфора пентасульфид с NaOH :
Dith Иофосфорная кислота получается обработкой дитиофосфата бария серной кислотой :
Оба Na 3PO2S2и особенно H 3PO2S2склонны к гидролизу до их монотио-производных.
Тритиофосфат представляет собой анион [POS 3 ], который имеет симметрию C 3v. Тетратиофосфат представляет собой анион [PS 4 ], который имеет симметрию T d.
 Равновесие димеризации, наблюдаемое для PS. 3.
Равновесие димеризации, наблюдаемое для PS. 3.Ряд этих анионов известен. Некоторые из них вызвали интерес как компоненты в проводниках на быстрых ионах для использования в твердотельных батареях. Бинарные тиофосфаты не демонстрируют большого разнообразия аналогичных анионов P-O, но содержат сходные структурные особенности, например, P имеет 4 координаты, образуются связи P-S-P и есть связи P-P. Одно отличие состоит в том, что ионы могут включать полисульфидные фрагменты из 2 или более атомов S, тогда как в анионах P-O присутствует только реактивная -O-O-, пероксо, звено.