 | |
| Клинические данные | |
|---|---|
| Торговые названия | Тробицин |
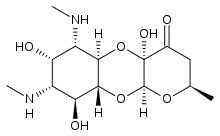
| Другие названия | (2R, 4aR, 5aR, 6S, 7S, 8R, 9S, 9aR, 10aS) -4a, 7,9-тригидрокси-2-метил-6,8-бис (метиламино) декагидро-4H-пирано [2,3-b] [1, 4] бензодиоксин-4-он |
| AHFS / Drugs.com | Монография |
| Беременность. категория |
|
| Пути. администрации | IM |
| код УВД | |
| Правовой статус | |
| Правовой статус |
|
| Идентификаторы | |
Название ИЮПАК
| |
| Номер CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL |
|
| CompTox Dashboard (EPA ) | |
| ECHA InfoCard | 100.015.374 |
| Химические и физические данные | |
| Формула | C14H24N2O7 |
| Молярная масса | 332,353 г · моль |
| 3D-модель (JSmol ) | |
| Точка плавления | от 184 до 194 ° C (от 363 до 381 ° F) |
УЛЫБКИ
| |
InChI
| |
| (что это?) | |
Спектиномицин, продаваемый, среди прочего, под торговым названием Тробицин, является антибиотиком, полезным для лечение гонореи. Его вводят путем инъекции в мышцу.
Общие побочные эффекты включают боль в области инъекции, сыпь, тошноту, жар и проблемы со сном. Иногда могут возникать тяжелые аллергические реакции. Как правило, безопасно использовать во время беременности. Его могут использовать люди, страдающие аллергией на пенициллин или цефалоспорины. Он относится к классу препаратов аминоциклит и работает, останавливая выработку белка некоторыми бактериями.
Спектиномицин был открыт в 1961 году. Он включен в Список Всемирной организации здравоохранения. Основные лекарства, самые безопасные и эффективные лекарства, необходимые в системе здравоохранения. Он недоступен в США для использования людьми. Он изготовлен из бактерии Streptomyces spectabilis.
Дается путем внутримышечной инъекции для лечения гонореи, особенно у пациентов с аллергией на пенициллины.
. Этот антибиотик больше не доступен в Соединенных Штатах для использования человеком, но все еще доступен для использования в ветеринарии.
Побочные эффекты включают зуд, озноб, боль в животе и красную сыпь.
Спектиномицин связывается с субъединицей 30S бактериальной рибосомы и прерывает синтез белка. Одна форма устойчивости возникла в рибосомной РНК 16S в Pasteurella multocida.
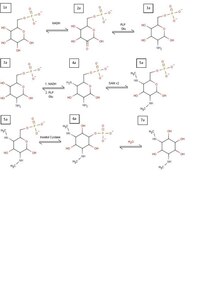 Предполагаемый биосинтез спектиномицина
Предполагаемый биосинтез спектиномицина Биосинтез спектиномицина начинается так же, как и у всех аминогликозидов, с образования кольцо с инозитом. Разница заключается в начальной модификации, которая образует инозитольное кольцо спектиномицина. Процесс начинается с глюкозо-6-фосфата (1a), который восстанавливается NADH с образованием кетона на C2 (2a). Этот кетон затем превращается в группу первичного амина в результате трансаминирования PLP и глутамина (3a). Этот процесс повторяется снова на C4 с образованием второго первичного амина (4a). Как только эти два амина присутствуют, глюкозное кольцо готово к метилированию через две молекулы S-аденозилметионина (5a). Благодаря этому метилированию кольцо глюкозы, наконец, готово к превращению в кольцо инозита через инозитолциклазу (6a). Затем его можно гидролизовать, чтобы избавиться от фосфатной группы, в результате чего инозитольное кольцо необходимо для спектиномицина (7a).
Пока все это происходит, происходит альтернативный путь создания функциональной группы сахара из аналогичного исходного продукта. На этом пути в качестве исходного продукта используется глюкозо-1-фосфат (1b). Он превращается в глюкозу TDP через TDP-синтазу (2b). Затем глюкоза TDP удаляет гидроксил из C6 с помощью фермента гидратазы (3b), который затем восстанавливается с помощью NADH в C4, создавая новый продукт (4b). При наличии этого кетона PLP и глутамин могут превращаться в первичный амин (5b), который затем можно удалить с помощью дезаминазы (6b). Это преобразование в 6b также сопровождается двойным восстановлением по C4 и C3 еще двумя молекулами NADH, давая конечный продукт, необходимый для образования аминогликозида. При этом продукты 7a и 6b могут объединяться, удаляя функциональную группу TDP и объединяясь с молекулой сахара с образованием аминогликозида спектиномицина.
Он находится в аминоциклите класс, тесно связанный с аминогликозидами. Спектиномицин промышленно производят ферментацией бактерии Streptomyces spectabilis. Спектиномицин вырабатывается в природе многими организмами, включая цианобактерии и различные виды растений. Он присутствует в геноме или пластоме многих пластид в виде spc оперона, который обычно имеет длину от двух до 10 генов. Разница в размере может быть связана с устранением устаревших генов или перехватом его функции ядерными генами. Спектиномицин в основном продуцируется организмами как защитный механизм от хищников.
Спектиномицин был открыт в 1961 году. В 2001 году произошел сбой в поставках.