| Комбинация | |
|---|---|
| вакцины АКДС | Вакцина |
| Вакцина против гепатита В | Вакцина |
| Вакцина против гемофильной инфекции | Вакцина |
| Клинические данные | |
| Торговые наименования | Квинваксем, Пентавак PFS и другие |
| Способы. введения | Внутримышечная инъекция |
| код АТС | |
| Идентификаторы | |
| ChemSpider |
|
A пентавалентная вакцина, также известная как вакцина 5-в-1, комбинированная вакцина с пятью отдельными вакцинами, соединенными в одну, предназначена для активной защиты людей от множества заболеваний.
Наиболее широко используемым примером является вакцина, защищающая от Haemophilus influenzae тип B (бактерия, вызывающая менингит, пневмонию и отит ), коклюш, столбняк, гепатит B и дифтерия. Общее название этой вакцины - дифтерия, столбняк, коклюш (w дырочная клетка), гепатита B (рДНК) и конъюгированной вакцины Haemophilus influenzae типа B (абсорбированная) или АКДС - HepB - Hib. Эта пентавалентная вакцина в значительной степени вытеснила другие комбинированные педиатрические вакцины, особенно в странах со средним и низким уровнем доходов. К 2013 году пентавалентные вакцины составляли 100% вакцин, содержащих АКДС, закупленных ЮНИСЕФ, который поставляет вакцины значительной части детей в мире.
Во время исследований и испытаний конъюгированная жидкость DTPw - HepB - Вакцина Hib имеет положительную безопасность при введении в качестве бустерной вакцины маленьким детям, которым был проведен курс вакцинации с другой пятивалентной бустерной вакциной, требующей изменения конституции, а также признано адекватно иммуногенным.
В октябре 2004 года Европейское агентство по лекарственным средствам предоставило разрешение на продажу в ЕС пентавалентной вакцины Quintanrix, производства GlaxoSmithKline. Кинтанрикс был добровольно отозван производителем в 2008 году.
В сентябре 2006 года первый состав пятивалентной вакцины получил предварительное одобрение от Всемирной организации здравоохранения.
В 2012 году ЮНИСЕФ и Всемирная организация здравоохранения выпустили и рекомендовали совместное заявление для Отдела иммунизации, Министерства здравоохранения и благополучия семьи, правительства Индии и других развивающихся стран в отдельных документах об использовании пятивалентных вакцин для защиты от пяти заболеваний. среди основных причин смерти детей, предотвратимых с помощью вакцин.
К 2013 году пентавалентные вакцины составляли 100% АКДС -содержащих вакцин, закупленных ЮНИСЕФ, который поставляет вакцины большей части детей в мире.
В 2014 году Южный Судан стал последней из 73 поддерживаемых ГАВИ стран, которые внедрили вакцину «пять в одном».
В мае 2010 года Crucell NV объявила о выделении 110 миллионов долларов США отделения ЮНИСЕФ для поставки своей пятивалентной детской вакцины Quinvaxem в развивающиеся страны.
В ноябре 2010 года государственно-частный консорциум ГАВИ объявил, что стоимость пятивалентной вакцины цена вакцины для стран с формирующимся рынком упала ниже 3,00 долларов США за дозу.
Страны с высоким уровнем дохода, как правило, используют альтернативные препараты с использованием бесклеточного коклюша (Pa), который имеет более благоприятный профиль побочных эффектов, чем цельный -клеточные коклюшные компоненты. В Европе широко используются шестивалентные вакцины, которые также содержат инактивированную вакцину против полиомиелита (IPV ). В США две пентавалентные вакцины, получившие разрешение на продажу, содержат IPV, а не вакцину против гепатита B (вакцина DTaP-IPV / Hib ) или вакцина Hib (вакцина DTaP-IPV-HepB ).
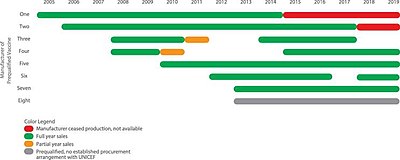
Число производителей, производящих сертифицированную пятивалентную вакцину.

Все цены на пятивалентные вакцины упали, и ценовая дискриминация практически исчезла. График GAVI; цены вне ЮНИСЕФ не показаны
В В 2013 г. было обнаружено, что вакцины Pentavac PFS поставлялись в двух разных упаковках: один набор с датами изготовления и сроком годности поставлялся частным больницам, а другой набор без даты изготовления и срока годности поставлялся распределены в государственные больницы. Позже выяснилось, что недатированные вакцины поставлялись ЮНИСЕФ и соответствовали Закону Индии.
Шри-Ланка представила Квинваксем в январе 2008 года. В течение 3 месяцев было получено четыре сообщения о смерти и 24 сообщения о подозрении на гипотонический гипор. Ответные эпизоды вызвали внимание регулирующих органов и предупредительную приостановку первоначальной партии вакцины. Последующая смерть, которая произошла со следующей партией в апреле 2009 года, вынудила власти приостановить использование пентавалентной вакцины и возобновить вакцинацию DTwP и гепатит B. После расследования, проведенного независимыми национальными и международными экспертами, вакцина была повторно введена в действие в 2010 году.
Бутан представил Easyfive-TT в сентябре 2009 года. Выявлено 5 случаев энцефалопатии и / или менингоэнцефалита вскоре после того, как пентавалентная вакцинация вынудила власти приостановить вакцинацию 23 октября 2009 г. Впоследствии были выявлены и расследованы еще 4 серьезных случая, связанных с вакциной, введенной до приостановки. После всестороннего обзора, проведенного независимыми национальными и международными экспертами, вакцина была повторно введена в действие в 2011 году.
С декабря 2012 года по март 2013 года в Вьетнаме было зарегистрировано девять смертей. детей, которые недавно получили инъекции пятивалентной вакцины Квинваксем. 4 мая 2013 года Министерство здравоохранения Вьетнама объявило о приостановке использования Квинваксема.
После анализа случаев, проведенного национальными экспертами совместно с сотрудниками ВОЗ и ЮНИСЕФ и независимым клиницистом, связи нет. с вакцинацией можно было идентифицировать. Случаи смерти, о которых сообщалось во Вьетнаме, были связаны со случайными проблемами со здоровьем, связанными со временем, но не связанными с применением Квинваксема, или случаями, по которым доступная информация не позволяла сделать однозначный вывод, но не было клинических признаков, соответствующих применению. вакцины. В отчете ВОЗ подчеркивается, что было введено более 400 миллионов доз квинваксема и что ни разу не было связано никаких смертельных побочных эффектов с применением квинваксема или аналогичных вакцин.
После дополнительных отчетов из Индия, Шри Ланка и Бутан из-за небольшого числа серьезных нежелательных явлений после иммунизации пентавалентными вакцинами, ВОЗ обратилась к группе независимых экспертов по всему миру с просьбой рассмотреть безопасность вакцины. Этот обзор проводился 12-13 июня 2013 г. и пришел к выводу, что пентавалентные вакцины не могут вызывать необычных реакций. 20 июня 2013 года Министерство здравоохранения объявило, что Вьетнам возобновит использование Квинваксема.
События, о которых сообщается в этих азиатских странах, вызвали неуверенность общественности в отношении использования пятивалентных вакцин для распространения в других развивающихся странах. В ответ на это и соответствующее распространение неточной информации о безопасности вакцин Индийская академия педиатрии выпустила заявление в поддержку пятивалентных вакцин.
Обычные версии пятивалентных вакцин включают Quinvaxem, Pentavac PFS, Easyfive TT, ComBE Five, Shan5 и Pentabio.
| Вакцина | Производитель | Дата предварительной квалификации ВОЗ |
|---|---|---|
| Quinvaxem | Crucell | 26 сентября 2006 г. |
| Pentavac PFS | Институт сывороток Индии | 23 июня 2010 г. |
| Easyfive TT | Panacea Biotec | 2 октября 2013 г. |
| ComBE Five | Biological E. Limited | 1 сентября 2011 г. |
| Shan5 | Shantha Biotechnics | 29 апреля 2014 г. |
| Pentabio | Bio Farma | 19 декабря 2014 г. |
| На Wikimedia Commons есть материалы, связанные с пентавалентной вакциной. |