 Структура молибдата
Структура молибдата  3D модель иона молибдата
3D модель иона молибдата В химии молибдат - это соединение, содержащее оксоанион с молибденом в его наивысшей степени окисления 6. Молибден может образовывать очень большой диапазон таких оксоанионов, которые могут быть дискретными структурами или полимерными протяженными структурами, хотя последние встречаются только в твердом состоянии.. Более крупные оксоанионы входят в группу соединений, называемых полиоксометаллатами, и поскольку они содержат только один тип атома металла, их часто называют изополиметаллатами. Размер дискретных оксоанионов молибдена варьируется от простейшего МоО2- 4, обнаруженный в молибдате калия, вплоть до чрезвычайно крупных структур, обнаруживаемых в изополимолибденовых синих, которые содержат, например, 154 атома Мо. Поведение молибдена отличается от других элементов в группе 6. Хром только формирует хроматы, CrO2- 4, Cr 2О2- 7, Cr 3О2- 10 и Cr 4О2- 13ионы, которые все основаны на тетраэдрическом хроме. Вольфрам похож на молибден и образует множество вольфрамов, содержащих 6-координатный вольфрам.
Примеры оксоанионов молибдата:
Названия молибдатов обычно следует соглашению о префиксе, чтобы показать количество присутствующих атомов Мо. Например, димолибдат на 2 атома молибдена; тримолибдат для 3 атомов молибдена и т. д. Иногда степень окисления добавляется как суффикс, например, в пентамолибдате (VI). Гептамолибдат-ион, Мо 7О6- 24, часто называют «парамолибдатом».
Более мелкие анионы, МоО2- 4и Мо 2О2- 7имеют тетраэдрические центры. В MoO2- 4четыре атома кислорода эквивалентны, как в сульфате и хромате, с одинаковыми длинами связей и углами. Пн 2О2- 7 можно рассматривать как два тетраэдра, разделяющих угол, то есть с одним мостиковым атомом O. В более крупных анионах молибден обычно, но не исключительно, 6 координируется с ребрами или вершинами общих октаэдров MoO 6. Октаэдры искажены, типичные длины связей МО составляют:
Мо 8О4- 26 анион содержит как октаэдрический, так и тетраэдрический молибден и может быть выделен в 2 изомерных формах, альфа и бета.
На изображении гексамолибдата ниже показаны координационные полиэдры. Изображение гептамолибдата показывает плотноупакованный характер атомов кислорода в структуре. Ион оксида имеет ионный радиус 1,40 Å, молибден (VI) намного меньше, 0,59 Å. Имеются сильные сходства между структурами молибдатов и оксидов молибдена ( MoO 3, MoO 2 и оксиды « кристаллографического сдвига », Mo 9 O 26 и Mo 10 O 29), все структуры которых содержат ионы оксидов с плотной упаковкой.

(a) [Mo 6 O 19 ] 2− (b) [Mo 7 O 24 ] 6−

Гексамолибдат
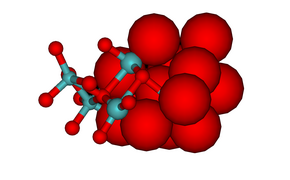
Гептамолибдат
Когда MoO 3, триоксид молибдена растворяется в растворе щелочи, простой MoO2- 4 анион продуцируется:
При понижении pH происходит конденсация с потерей воды и образованием связей Mo – O – Mo. Показана стехиометрия, приводящая к гекса-, гепта- и октамолибдатам:
Известно много пероксомолибдатов. Они имеют тенденцию образовываться при обработке солей молибдата перекисью водорода. Примечательным является равновесие мономер-димер [Mo 2 O 3 (O 2) 2 (H 2 O) 2 ] 2− ⇌ [Mo 2 O 3 (O 2) 4 (H 2 O) 2 ] 2−. Также известен, но нестабилен [Mo (O 2) 4 ] 2- (см. Тетрапероксохромат калия (V) ). Некоторые родственные соединения находят применение в качестве окислителей в органическом синтезе.
Красный анион тетратиомолибдата образуется при обработке растворов молибдата сероводородом :
Как и сам молибдат, MoS2- 4 подвергается конденсации в присутствии кислот, но эти конденсации сопровождаются окислительно-восстановительными процессами.
Молибдаты широко используются в катализе. С точки зрения масштаба, крупнейшим потребителем молибдата является предшественник катализаторов гидрообессеривания, процесса, с помощью которого сера удаляется из нефти. Висмут молибдаты, номинально композиция Би 9 ОУП 12 O 52, катализирует аммиачный из пропилена до акрилонитрила. Молибдаты железа используются в промышленности для катализирования окисления метанола до формальдегида.
Молибдат натрия использовался при очистке промышленных вод в качестве ингибитора коррозии. Первоначально считалось, что он будет хорошей заменой хромату, когда хромат был запрещен из-за токсичности. Однако молибдат требует высоких концентраций при использовании отдельно, поэтому обычно добавляются дополнительные ингибиторы коррозии, и он в основном используется в высокотемпературных контурах охлаждения с замкнутым контуром. Согласно экспериментальному исследованию, молибдат был признан эффективным биоцидом против микробиологической коррозии (MIC), где добавление 1,5 мМ молибдата в день приводило к снижению скорости коррозии на 50%.
Молибдаты (особенно FeMoO 4, Fe 2 (MoO 4) 3, NiMoO 4, CoMoO 4 и MnMoO 4) использовались в качестве анодных или катодных материалов в водных конденсаторах. Из-за псевдоемкостного накопления заряда наблюдается удельная емкость до 1500 Ф г -1.
Радиоактивный молибден-99 в форме молибдата используется в качестве исходного изотопа в генераторах технеция-99m для визуализации в ядерной медицине.
Для фиксации азота необходимы молибдоэнзимы в бобовых (например, соевых бобах, акации и т. Д.). По этой причине удобрения часто содержат небольшое количество солей молибдата. Покрытие обычно составляет менее килограмма на акр.
Хромовые молибдатные пигменты - это специальные, но коммерчески доступные пигменты. Молибдат (обычно в форме молибдата калия) также используется в аналитическом колориметрическом тестировании концентрации кремнезема в растворе, называемом методом молибденового синего. Кроме того, он используется в колориметрическом определении количества фосфата в сочетании с красителем малахитовый зеленый.