 | |
 | |
 | |
| Имена | |
|---|---|
| Название IUPAC Молибдат натрия | |
| Другие названия Молибдат динатрия | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.028.683 |
| Номер EC |
|
| PubChem CID | |
| номер RTECS |
|
| UNII |
|
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
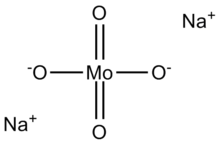
| Химическая формула | Na2MoO 4 |
| Молярная масса | 205,92 г / моль (безводный). 241,95 г / моль (дигидрат) |
| Внешний вид | Белый порошок |
| Плотность | 3,78 г / см, твердое вещество |
| точка плавления | 687 ° C (1269 ° F; 960 K) |
| Растворимость в воде | 84 г / 100 мл (100 ° C) |
| Показатель преломления (nD) | 1,714 |
| Опасности | |
| Паспорт безопасности | Внешний MSDS |
| NFPA 704 (огненный алмаз) |  0 2 0 0 2 0 |
| Температура вспышки | Невоспламеняющийся |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 4000 мг / кг (крыса, перорально) |
| LC50(средняя концентрация ) | >2080 мг / м (крыса, 4 часа) |
| Родственные соединения | |
| Другие анионы | Хромат натрия. Вольфрамат натрия |
| Другое катионы | молибдат аммония |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки ink | |
Молибдат натрия, Na 2 MoO 4, полезен как источник молибден. Он часто встречается в виде дигидрата Na 2 MoO 4 · 2H 2 O.
Анион молибдата (VI) является тетраэдрическим. Два катиона натрия взаимодействуют с каждым анионом.
Молибдат натрия впервые был синтезирован методом гидратации. Более удобный синтез осуществляется путем растворения MoO 3 в гидроксиде натрия при 50–70 ° C и кристаллизации отфильтрованного продукта. Безводную соль получают нагреванием до 100 ° C.
В сельском хозяйстве используется 1 миллион фунтов стерлингов в год в качестве удобрений. В частности, его использование было предложено для обработки брокколи и цветной капусты в почвах с дефицитом молибдена. Однако следует проявлять осторожность, поскольку молибдат натрия на уровне 0,3 ppm может вызвать дефицит меди у животных, особенно крупного рогатого скота.
Он используется в промышленности для ингибирования коррозии, поскольку является неокисляющим анодным ингибитором. Добавление молибдата натрия значительно снижает потребность в нитритах для жидкостей, ингибированных нитрит-амином, и улучшает защиту от коррозии жидкостей на основе карбоксилатных солей.
В промышленных системах водоподготовки, где гальваническая коррозия является потенциальной из-за биметаллической конструкции, применение молибдата натрия предпочтительнее нитрита натрия. Молибдат натрия имеет преимущество в том, что дозирование более низких частей на миллион молибдата позволяет снизить проводимость циркулирующей воды. Молибдат натрия на уровне 50-100 частей на миллион обеспечивает такие же уровни ингибирования коррозии, что и нитрит натрия при уровнях 800+ частей на миллион. За счет использования более низких концентраций молибдата натрия проводимость поддерживается на минимальном уровне и, таким образом, снижаются потенциалы гальванической коррозии.
При взаимодействии с борогидридом натрия количество молибдена уменьшается в оксид молибдена (IV) с более низкой валентностью :
Молибдат натрия реагирует с кислотами дитиофосфатов:
, который далее реагирует с образованием [MoO 3(S2P (OR) 2)4].
Молибдат натрия несовместим с щелочными металлами, наиболее распространенными металлами и окислителями. Он взорвется при контакте с расплавленным магнием. Он будет бурно реагировать с интергалогенами (например, пентафторидом брома ; трифторидом хлора ). Его реакция с горячим натрием, калием или литием раскалена.
| На Викискладе есть средства массовой информации, связанные с молибдатом натрия. |