 Структура Кеггина
Структура Кеггина  Доктор Джеймс Ф. Кеггин, открывший структуру Кеггина.
Доктор Джеймс Ф. Кеггин, открывший структуру Кеггина.  Структура Кеггина
Структура Кеггина Структура Кеггина - наиболее известная структурная форма для гетерополикислоты. Это структурная форма анионов α-Кеггина, которые имеют общую формулу [XM 12O40], где X - гетероатом (чаще всего P, Si или B), M - атом адденда (наиболее распространенными являются молибден и вольфрам ), а О представляет собой кислород. Структура самоорганизуется в кислотном водном растворе и является наиболее стабильной структурой полиоксометаллатов катализаторов.
Первый анион α-Кеггина, фосфомолибдат аммония ((NH 4)3[PMo 12O40]), был впервые описан Берцелиусом в 1826 году. В 1892 году, Бломстранд предложил структуру фосфорномолибденовой кислоты и других поликислот в виде цепной или кольцевой конфигурации. Альфред Вернер, используя координационные соединения идеи Копо, попытался для объяснения структуры кремневольфрамовой кислоты. Он предположил, что центральная группа, ион [SiO 4 ], заключена в четыре [RW 2O6], где R - унипозитивный ион. [RW 2O6] связаны с центральной группой прима ry. Еще две группы R 2W2O7были связаны с центральной группой вторичными валентностями. Это предложение учитывает характеристики большинства поликислот, но не всех.
В 1928 г. Линус Полинг предложил структуру для анионов α-Кеггина, состоящую из тетраэдрического центрального иона, [XO 4 ], заключенного в клетку. двенадцатью октаэдрами WO 6. В этой предложенной структуре три кислорода на каждом из октаэдров разделяют электроны с тремя соседними октаэдрами. В результате 18 атомов кислорода использовались как мостиковые атомы между атомами металла. Остальные атомы кислорода связаны с протоном . Эта структура объясняет многие наблюдаемые характеристики, такие как основность солей щелочного металла и гидратированная форма некоторых солей. Однако структура не может объяснить структуру дегидратированных кислот.
с использованием дифракции рентгеновских лучей экспериментально определена структура анионов α-Кеггина в 1934 году. Структура Кеггина учитывает как гидратированные, так и дегидратированные анионы α-Кеггина без необходимости значительное структурное изменение. Структура Кеггина является широко принятой структурой для анионов α-Кеггина.
 =
=  +
+ 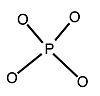
. Структура имеет полную тетраэдрическую симметрию и состоит из одного гетероатома окружен четырьмя атомами кислорода с образованием тетраэдра. Гетероатом расположен в центре и окружен 12 октаэдрическими MO6-частицами, связанными друг с другом соседними атомами кислорода. Всего имеется 24 мостиковых атома кислорода, которые связывают 12 дополнительных атомов. Металлические центры в 12 октаэдрах расположены на сфере почти на равном расстоянии друг от друга в четырех единицах M 3O13, что придает всей структуре общую тетраэдрическую симметрию. Длина связи между атомами варьируется в зависимости от гетероатома (X) и атомов присоединения (M). Для 12-фосфорновольфрамовой кислоты Кеггин определил, что длина связи между гетероатомом и каждым из четырех центральных атомов кислорода составляет 1,5 Å. Длина связи от центрального кислорода к атомам присоединений составляет 2,43 Å. Длина связи между атомами присоединения и каждым мостиковым кислородом составляет 1,9 Å. Остальные 12 атомов кислорода, каждый из которых связан двойной связью с атомом присоединения, имеют длину связи 1,70 Å. Поэтому октаэдры искажаются. Эта структура позволяет молекуле гидратироваться и дегидратироваться без значительных структурных изменений, и молекула термически стабильна в твердом состоянии для использования в парофазных реакциях при высоких температурах (400-500 ° C).
Включая исходную структуру Кеггина, имеется 5 изомеров, обозначенных префиксами α-, β-, γ-, δ- и ε-. Исходная структура Кеггина обозначается α-. Эти изомеры иногда называют изомерами Бейкера, Бейкера-Фиггиса или вращательными изомерами. Они включают различную вращательную ориентацию звеньев Мо 3O13, что снижает симметрию всей структуры.
Термин лакунарный применяется к ионам, у которых отсутствует фрагмент, иногда называемым дефектными структурами. Примерами являются (XM 11O39) и (XM 9O34), образованные удалением из структуры Кеггина достаточного количества атомов Mo и O для удаления 1 или 3 соседних октаэдров MO 6. Структура Доусона, X 2M18O62, состоит из двух лакунарных фрагментов Кеггина с 3 недостающими октаэдрами.
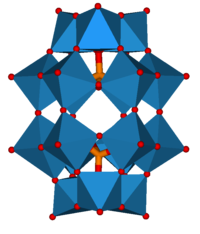 Структура Доусона
Структура Доусона Кластерный катион (Al 13O4(OH) 24(H2O)12) имеет структуру Кеггина с тетраэдрическим атомом Al в центре кластер координирован до 4 атомов кислорода. Формула может быть выражена как (AlO 4Al12(OH) 24(H2O)12). Этот ион обычно называют ионом Al13. Аналог Ga13 известен необычным ионным соединением с катионом Al13 и охарактеризован полиоксоанион Кеггина.
Из-за схожего химического состава алюминия и железа в водной среде он имеет Долгое время считалось, что аналогичный поликатион железа должен быть изолирован от воды. Более того, в 2007 году была определена структура ферригидрита, которая состоит из ионов Кеггина железа. Это еще больше захватило воображение ученых и их стремление выделить железный ион Кеггина. В 2015 г. ион Кеггина железа был выделен из воды, но в виде полианиона с зарядом −17; и требовалась защита химии. Вода, связанная с железом, очень кислая; поэтому сложно захватить промежуточную форму иона Кеггина без объемных и непротонных лигандов вместо воды, которая содержится в ионе Кеггина алюминия. Однако более важными в этом синтезе были противоионы висмута (Bi), которые обеспечивали высокий положительный заряд для стабилизации высокого отрицательного заряда гептадекавалентного полианиона.
Стабильность структуры Кеггина позволяет легко восстанавливать содержание металлов в анионе. В зависимости от растворителя, кислотности раствора и заряда аниона α-Кеггина, его можно обратимо уменьшить в одно- или многоэлектронные стадии. Например, силиковольфраматный анион может быть восстановлен до 20-го состояния. Некоторые анионы, такие как кремневольфрамовая кислота, достаточно сильны в качестве кислоты, как серная кислота, и могут использоваться вместо нее в качестве кислотного катализатора.
Как правило, анионы α-Кеггина синтезируют в кислых растворах. Например, 12- фосфорновольфрамовая кислота образуется путем конденсации иона фосфата с ионами вольфрамата. Образующаяся гетерополикислота имеет структуру Кеггина.
анионы α-Кеггина, используемые в качестве катализатора в следующие реакции: гидратация, полимеризация и реакция окисления в качестве катализаторов. Японские химические компании коммерциализировали использование соединений для гидратации пропена, окисления метакролеина, гидратации изобутена, гидратации н-бутена <59.>и полимеризация ТГФ.
12- Фосфорновольфрамовая кислота, соединение Дж. Ф. Кеггина, используемое для определения структуры, можно приобрести коммерчески.. Другие соединения, содержащие анион α-Кеггина, такие как кремневольфрамовая кислота и фосфорномолибденовая кислота, также коммерчески доступны в Aldrich Chemicals, Fisher Chemicals, Alfa Aesar, VWR Chemical, American Elements и т. Д.