 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гексакарбонил вольфрам | |
| Другие имена Карбонил вольфрама гексакарбонилвольфрам | |
| Идентификаторы | |
| Количество CAS | |
| 3D модель ( JSmol ) | |
| ECHA InfoCard | 100.034.423 |
| Номер ЕС | |
| PubChem CID | |
| Панель управления CompTox ( EPA) | |
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
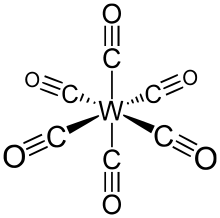
| Химическая формула | C 6 O 6 Вт |
| Молярная масса | 351,901 г / моль |
| Появление | Бесцветное твердое вещество |
| Плотность | 2,65 г / см 3 |
| Температура плавления | 170 ° С (338 ° F, 443 К) (разлагается) |
| Растворимость в воде | нерастворимый |
| Растворимость | экономно в THF |
| Опасности | |
| Основные опасности | Воспламеняющийся, источник CO |
| Родственные соединения | |
| Другие катионы | Гексакарбонил хрома Гексакарбонил молибдена |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| | |
| Ссылки на инфобоксы | |
Гексакарбонил вольфрама (также называемый карбонилом вольфрама) представляет собой химическое соединение с формулой W (CO) 6. Этот комплекс дал начало первому примеру дигидрогенного комплекса.
Это бесцветное соединение, как и его аналоги из хрома и молибдена, примечательно как летучее, стабильное на воздухе производное вольфрама в его нулевой степени окисления.
W (CO) 6 получают путем сокращения из ВКТ 6 под давлением моноксида углерода. Состав относительно устойчив на воздухе. Умеренно растворим в неполярных органических растворителях. Карбонил вольфрама широко используется в технике осаждения под действием электронного луча - он легко испаряется и разлагается под действием электронного луча, обеспечивая удобный источник атомов вольфрама.
W (CO) 6 Принимает октаэдрическую геометрию, состоящие из шести стержнеобразных СО лиганды излучающего от центрального атома W с дипольным моментом 0 D.
Все реакции W (CO) 6 начинаются с вытеснения части лигандов CO в W (CO) 6. W (CO) 6 ведет себя так же, как Mo (CO) 6, но имеет тенденцию образовывать соединения, которые кинетически более устойчивы.
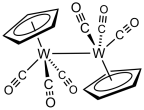 Циклопентадиенилтрикарбонилдимер вольфрама ((C 5 H 5.) 2 W 2 (CO) 6) получают из W (CO) 6.
Циклопентадиенилтрикарбонилдимер вольфрама ((C 5 H 5.) 2 W 2 (CO) 6) получают из W (CO) 6. Обработка гексакарбонила вольфрама циклопентадиенидом натрия с последующим окислением образовавшегося NaW (CO) 3 (C 5 H 5) дает димер трикарбонила циклопентадиенил вольфрама.
Одним из производных является дигидрогенный комплекс W (CO) 3 [P (C 6 H 11) 3 ] 2 (H 2).
Три из этих лигандов CO могут быть замещены ацетонитрилом. W (CO) 6 использовался для обессеривания сероорганических соединений и в качестве предшественника катализаторов метатезиса алкенов.
Как и все карбонилы металлов, W (CO) 6 является опасным источником летучих металлов, а также CO.