 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC трет-бутиллитий | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| Ссылка Beilstein | 3587204 |
| ChemSpider | |
| ECHA InfoCard | 100.008.939 |
| Номер ЕС |
|
| PubChem CID | |
| Номер ООН | 3394 |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | LiC. 4H. 9 |
| Молярная масса | 64,055 г · моль |
| Внешний вид | Бесцветное твердое вещество |
| Плотность | 660 мг / см |
| Точка кипения | от 36 до 40 ° C (от 97 до 104 ° F; От 309 до 313 K) |
| Растворимость в воде | Реагирует |
| Кислотность (pK a) | 45–53 |
| Опасности | |
| Пиктограммы GHS |      |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H225, H250, H260, H300, H304, H310, H314, H330, H336, H411 |
| Меры предосторожности GHS | P210, P222, P223, P231 + 232, P370 + 378, P422 |
| NFPA 704 (огненный алмаз) |  4 4 4 4 4 4 |
| Температура вспышки | -6,6 ° C (20,1 ° F; 266,5 K) |
| Родственные соединения | |
| Родственные соединения | н-бутиллитий. |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобокс | |
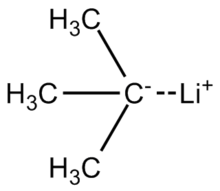
трет-Бутиллитий представляет собой химическое соединение с формулой (CH 3)3CLi. Как литийорганическое соединение, оно находит применение в органический синтез, так как это сильный основание, способное депротонировать многие углеродные кислоты, включая бензол. трет-бутиллитий коммерчески доступен в виде углеводородных растворов; его обычно не готовят в лаборатории. О его синтезе впервые сообщил Р. B. Woodward в 1941 году.
Как и другие литийорганические соединения, трет-бутиллитий представляет собой кластер. В то время как н-бутиллитий существует как в виде гексамера, так и в виде тетрамера, трет-бутиллитий существует в виде тетрамера со структурой кубана. Связывание в литийорганических кластерах включает сигма-делокализацию и значительную связь Li-Li.
Связь литий-углерод в трет-бутиллитии сильно поляризована, имея около 40 процентов ионного характера. Молекула реагирует как карбанион, как это представлено этими двумя резонансными структурами. (С учетом расчетов полярности связи C – Li, «реальная» структура одиночной молекулы трет-бутиллития, вероятно, является почти средней из двух показанных вкладов в резонанс, в которых центральный атом углерода имеет частичное значение ~ 50%. отрицательный заряд, в то время как атом лития имеет частичный положительный заряд ~ 50%.)

Подобно н-бутиллитию, трет-бутиллитий может использоваться для обмена лития с галогенами и для депротонирования аминов и активированных соединений C — H.
Известно, что это соединение и другие алкиллитиевые соединения реагируют с эфирными растворителями; период полураспада трет-бутиллития составляет 60 минут при 0 ° C в диэтиловом эфире, 40 минут при -20 ° C в тетрагидрофуране (THF), и примерно 11 минут при -70 ° C в диметоксиэтане. В этом примере показана реакция трет-бутиллития с (ТГФ):


Чтобы свести к минимуму разложение под действием этих растворителей, реакции с участием трет-бутиллития часто проводят при очень низких температурах в специальных растворителях, таких как Trapp смесь растворителей.
трет-бутиллитий - это пирофорное вещество, что означает, что оно легко загорается при контакте с воздухом. (Точное определение пирофорного материала - это вещество, которое «самовоспламеняется [ы] на воздухе при температуре 54,55 ° C (130,19 ° F) или ниже»).) Растворители, используемые в обычных коммерческих препаратах, сами по себе горючие. Хотя с этим соединением можно работать, используя перенос канюли, следы трет-бутиллития на кончике иглы или канюли могут загореться и забить канюлю солями лития. В то время как некоторые исследователи воспринимают этот эффект «пилотного света» как признак того, что продукт «свежий» и не испортился из-за времени или неправильного хранения / обращения, другие предпочитают заключать кончик иглы или канюлю в короткую стеклянную трубку, которая является промывают инертным газом и закрывают с каждого конца перегородками. Произошли серьезные лабораторные аварии, связанные с трет-бутиллитием. Например, в 2008 году штатный научный сотрудник Шехарбано Санджи в лаборатории Патрика Харрана в Калифорнийском университете в Лос-Анджелесе скончался от тяжелой болезни. сгорел от огня, воспламененного трет-бутиллитием.
Крупномасштабные реакции могут привести к неконтролируемым реакциям, пожарам и взрывам, когда трет-бутиллитий смешивают с простыми эфирами, такими как диэтиловый эфир и тетрагидрофуран. Может быть предпочтительным использование углеводородных растворителей.
Безвоздушные методы важны для предотвращения бурной реакции этого соединения с кислородом и влагой в воздухе: