 | |
| Имена | |
|---|---|
| Название IUPAC Хлорид платины (IV) | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) |
|
| ChemSpider | |
| ECHA InfoCard | 100.033. 300 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
SMILES
| |
| Свойства | |
| Химическая формула | PtCl 4 |
| Молярная масса | 336,89 г / моль |
| Внешний вид | коричнево-красный порошок |
| Плотность | 4,303 г / см (безводный). 2,43 г / см (пентагидрат) |
| Температура плавления | 370 ° C (698 ° F; 643 K) разлагается |
| Точка кипения | разлагается |
| Растворимость в воде | 58,7 г / 100 мл (безводный). очень растворим (пентагидрат) |
| Растворимость | безводный. растворим в ацетоне. мало растворим в этаноле. нерастворим в эфире пентагидрате. растворим в спирте, эфир |
| Магнитная восприимчивость (χ) | -93,0 · 10 см / моль |
| Структура | |
| Молекулярная форма | Квадратный плоский |
| Опасности | |
| Классификация ЕС (DSD) (устаревший) | не указан |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 276 мг / кг (крыса, перорально) |
| Родственные соединения | |
| Другие анионы | Бромид платины (IV). Фторид платины (IV). Сульфид платины (IV) |
| Другие катионы | Иридий (IV) хлорид |
| Родственные соединения | Хлорид платины (II). Фторид платины (VI) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на информационное окно | |
Плата хлорид инума (IV) представляет собой неорганическое соединение из платины и хлора с эмпирической формулой PtCl 4. Это коричневое твердое вещество содержит платину в степени окисления 4+.
Типичная для Pt (IV), металлические центры принимают октаэдрическую координационную геометрию, {PtCl 6 }. Эта геометрия достигается за счет образования полимера, в котором половина хлоридных лигандов соединяется между платиновыми центрами. Из-за своей полимерной структуры PtCl 4 растворяется только при разрыве хлоридных мостиковых лигандов. Таким образом, добавление HCl дает H 2 PtCl 6. основание Льюиса аддукты Pt (IV) типа цис-PtCl 4L2известны, но большинство из них получают окислением производных Pt (II).
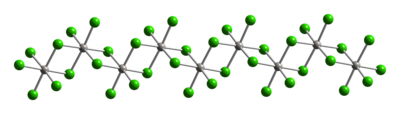 |
PtCl 4 в основном встречается при обращении с платинохлористоводородной кислотой, полученной растворением металлической Pt в царской водке. Нагревание H 2 PtCl 6 дает PtCl 4:
Если удалить избыток кислот, PtCl 4 кристаллизуется из водных растворов в виде больших красных кристаллов пентагидрата PtCl. 4 · 5 (H 2 O), который может быть дегидратирован путем нагревания до примерно 300 ° C в токе сухого хлора. Пентагидрат стабилен и используется в коммерческой форме. PtCl 4.
Обработка PtCl 4 водным основанием дает ион [Pt (OH) 6 ]. С помощью метил реагентов Гриньяра с последующим частичным гидролизом, PtCl 4 превращается в кубовидный кластер [Pt (CH 3)3(OH)] 4. При нагревании PtCl 4 выделяется хлор чтобы получить PtCl 2 :
Более тяжелый галогенид es, PtBr 4 и PtI 4 также известны.