 | |||
| |||
| Имена | |||
|---|---|---|---|
| Другие имена Йодная (V) кислота | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| ChEBI | |||
| ChEMBL |
| ||
| ChemSpider | |||
| ECHA InfoCard | 100.029.056 | ||
| PubChem CID | |||
| UNII | |||
| Панель управления CompTox (EPA ) | |||
InChI
| |||
УЛЫБАЕТСЯ
| |||
| Свойства | |||
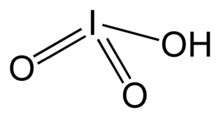
| Химическая формула | HIO 3 | ||
| Молярная масса | 175,91 г / моль | ||
| Внешний вид | Белое твердое вещество | ||
| Плотность | 4,62 г / см, твердое вещество | ||
| Температура плавления | 110 ° C (230 ° F; 383 K) | ||
| Растворимость в воде | 269 г / 100 мл (20 ° C) | ||
| Кислотность (pK a) | 0,75 | ||
| Основание конъюгата | Йодат | ||
| Магнитная восприимчивость (χ) | -48,0 · 10 см / моль | ||
| Опасности | |||
| Основные опасности | кислоты, коррозионные вещества, окислители | ||
| NFPA 704 (огненный алмаз) |  0 3 1 OX 0 3 1 OX | ||
| Температура вспышки | Невоспламеняющиеся | ||
| Родственные соединения | |||
| Прочие катионы | Иодат лития. Иодат калия | ||
| Родственные галогены оксокислоты | Хлорная кислота. Бромная кислота | ||
| Родственные соединения | Йодоводородная кислота. Пятиокись йода. Периодная кислота | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки в ink | |||
Йодная кислота, HIO 3. Это белое водорастворимое твердое вещество. Его устойчивость контрастирует с нестабильностью хлорноватой кислоты и бромной кислоты. Йодная кислота содержит йод в степени окисления +5 и одна из самых стабильных оксокислот галогенов. Wh При нагревании образцы дегидратируются с образованием пятиокиси йода. При дальнейшем нагревании пятиокись йода разлагается, давая смесь йода, кислорода и низших оксидов йода.
Йодная кислота может быть получен путем окисления йода I2сильными окислителями, такими как азотная кислота HNO. 3, хлор Cl. 2, хлорноватая кислота HClO. 3или перекись водорода H. 2O. 2, например:
Йодная кислота является относительно сильная кислота с pKa 0,75. Он сильно окисляет в кислом растворе, в меньшей степени в щелочном растворе. Когда йодная кислота действует как окислитель, продуктом реакции является либо йод, либо иодид-ион. В некоторых особых условиях (очень низкий pH и высокая концентрация хлорид-ионов, например, в концентрированной соляной кислоте) йодная кислота восстанавливается до трихлорида йода, соединения золотисто-желтого цвета в растворе, и дальнейшего восстановления не происходит. В отсутствие хлорид-ионов, когда имеется избыточное количество восстановителя, весь иодат превращается в иодид-ион. При избыточном количестве йодата часть йодата превращается в йод. Его можно использовать при подготовке к ионизации с образованием алкилгалогенидов.
Йодная кислота используется в качестве сильной кислоты в аналитической химии. Его можно использовать для стандартизации растворов как слабого, так и сильного оснований, используя метиловый красный или метиловый оранжевый в качестве индикатора ..
Йодная кислота может использоваться для синтеза натрия или йодата калия для увеличения содержания йода в соли.
Йодат является частью серии оксикислот, в которых йод может принимать степени окисления, равные -1, +1, +3, +5 или +7. Также известен ряд нейтральных оксидов йода.
| Степень окисления йода | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Имя | Йодоводород | Гипойодистая кислота | Йодистая кислота | Йодная кислота | Периодическая кислота |
| Формула | HI | HIO | HIO 2 | HIO 3 | HIO 4 или H 5IO6 |
.