Агостическое взаимодействие - термин в металлоорганической химии, обозначающий взаимодействие координационно-ненасыщенного переходного металла с Связь C-H, когда два электрона, участвующие в связи C-H, входят в пустую d-орбиталь переходного металла, что приводит к трехцентровой двухэлектронной связи. Многие каталитические превращения, например окислительное добавление и восстановительное отщепление, как предполагается, осуществляются через промежуточные соединения, проявляющие агостические взаимодействия. Агостические взаимодействия наблюдаются на протяжении всей металлоорганической химии в алкильных, алкилиденовых и полиенильных лигандах.
Термин агостик, происходящий от древнегреческого слова, означающего «держаться близко к себе», был придуман Морисом Брукхартом и Малькольм Грин, по предложению классика Джаспера Гриффина, чтобы описать это и многие другие взаимодействия между переходным металлом и связью C-H. Часто такие агостические взаимодействия включают алкильные или арильные группы, которые удерживаются близко к металлическому центру посредством дополнительной σ-связи.
Кратковременные взаимодействия между углеводородными заместителями и координационно-ненасыщенными комплексами металлов отмечались с 1960-х годов. Например, в дихлориде трис (трифенилфосфин ) рутения короткое взаимодействие наблюдается между центром рутения (II) и атомом водорода в орто-положении одного из девяти фенильных колец.. Комплексы борогидрида описаны с использованием модели трехцентровой двухэлектронной связи.
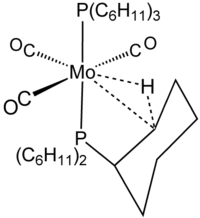 Mo (PCy 3 )2(CO) 3, с агостическим взаимодействием.
Mo (PCy 3 )2(CO) 3, с агостическим взаимодействием. Природа взаимодействия была предсказана в химии основной группы в структурной химии триметилалюминий.
Агостические взаимодействия лучше всего демонстрирует кристаллография. Данные нейтронной дифракции показали, что расстояния между связями C − H и M┄H равны На 5-20% больше, чем ожидалось для изолированного гидрида металла и углеводородов. Расстояние между металлом и водородом обычно составляет 1,8–2,3 Å, а угол M┄H-C находится в диапазоне 90 °. –140 °. Присутствие сигнала H ЯМР, который смещен в сильное поле от сигнала нормального арила или алкана, часто в область, обычно относящуюся к лигандам гидрид. Константа взаимодействия J CH обычно снижается до 70–100 Гц по сравнению с 125 Гц, ожидаемыми для нормальной sp углерод-водородной связи.
 Структура (C 2H5) TiCl 3(dmpe ), подчеркивая агостическое взаимодействие между метильной группой и Центр Ti (IV).
Структура (C 2H5) TiCl 3(dmpe ), подчеркивая агостическое взаимодействие между метильной группой и Центр Ti (IV). На основании экспериментальных и вычислительных исследований, стабилизация, возникающая в результате агостического взаимодействия, оценивается в 10–15 ккал / моль.. Недавние расчеты с использованием констант податливости указывают на более слабую стабилизацию (<10 kcal/mol). Thus, agostic interactions are stronger than most водородные связи. Агостические связи иногда играют роль в катализе, увеличивая «жесткость» в переходных состояниях. Например, в катализ Циглера – Натта высокоэлектрофильный металлический центр имеет агостические взаимодействия с растущей полимерной цепью. Эта повышенная жесткость влияет на стереоселективность процесса полимеризации.
 A сигма-комплекс, полученный из (MeC 5H4) Mn (CO) 3 и трифенилсилан.
A сигма-комплекс, полученный из (MeC 5H4) Mn (CO) 3 и трифенилсилан. Термин агостик зарезервирован для описания двухэлектронных, трехцентровых связывающих взаимодействий между углеродом, водородом и металлом. Двухэлектронная трехцентровая связь явно участвует в комплексообразовании H 2, например, в W (CO) 3 (PCy 3)2H2, который тесно связан с агостическим комплексом, показанным на рисунке. Силан часто связывается с металлическими центрами посредством агостикоподобных трехцентровых взаимодействий Si┄H − M. Поскольку эти взаимодействия не включают углерод, однако они не относятся к агостическим.
Определенные взаимодействия M┄H-C не классифицируются как агостические, но описываются термином анагостические. Анагостические взаимодействия имеют более электростатический характер. С точки зрения структуры анагостических взаимодействий, расстояния M┄H и углы M┄H − C попадают в диапазоны 2,3–2,9 Å и 110–170 ° соответственно.
Агостические взаимодействия выполняют ключевую функцию в полимеризации алкенов и стереохимии, а также в мигрирующей вставке.