| Тиоредоксин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
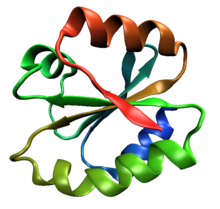 Одна молекула человеческого тиоредоксина (PDB ID 1ERT), канонический пример тиоредоксинового фолд-класса. Одна молекула человеческого тиоредоксина (PDB ID 1ERT), канонический пример тиоредоксинового фолд-класса. | |||||||||
| Идентификаторы | |||||||||
| Symbol | Тиоредоксин, Trx | ||||||||
| Pfam | PF00085 | ||||||||
| Pfam clan | CL0172 | ||||||||
| InterPro | IPR013766 | ||||||||
| PROSITE | PDOC00172 | ||||||||
| SCOPe | 3trx / SUPFAM | ||||||||
| CDD | cd01659 | ||||||||
| Membranome | 337 | ||||||||
| |||||||||
| Тиоредоксин | |
|---|---|
| Идентификаторы | |
| Символ | Trx |
| Мембранома | 260 |
тиоредоксиновая складка представляет собой белок кратный, общий для ферментов, которые катализируют образование дисульфидной связи и изомеризацию. Складка названа в честь канонического примера тиоредоксин и обнаруживается как в прокариотических, так и в эукариотических белках. Это пример альфа / бета-складки белка, который обладает активностью оксидоредуктазы. Пространственная топология складки состоит из четырехцепочечного антипараллельного бета-листа, зажатого между тремя альфа-спиралями. Топология жилы - 2134 с тремя антипараллельными остальным.
Несмотря на изменчивость последовательности во многих регионах В этой складке белки тиоредоксина имеют общую последовательность активного сайта с двумя реактивными остатками цистеина : Cys-XY-Cys, где X и Y часто, но не обязательно гидрофобны аминокислот. Восстановленная форма белка содержит две свободные тиольные группы у остатков цистеина, тогда как окисленная форма содержит дисульфидную связь между ними.
Различные белки, содержащие тиоредоксиновый фолд, сильно различаются по своей реакционной способности и pKa их свободных тиолов, что обусловлено способностью всего белка структура для стабилизации активированного тиолата. Хотя структура довольно согласована между белками, содержащими тиоредоксиновую складку, pKa чрезвычайно чувствительна к небольшим изменениям в структуре, особенно к размещению атомов основной цепи белка около первого цистеина.
Белки человека, содержащие этот домен, включают: