 Диаграмма Пурбе для железа.
Диаграмма Пурбе для железа. В электрохимии, диаграмма Пурбе, также известная как диаграмма потенциал / pH, EH-pH диаграмма или диаграмма pE / pH, отображает возможные стабильные (равновесные ) фазы водного электрохимическая система. Преобладающие границы ионов представлены линиями. Таким образом, диаграмму Пурбе можно читать так же, как стандартную фазовую диаграмму с другим набором осей. Как и фазовые диаграммы, они не учитывают скорость реакции или кинетические эффекты. Помимо потенциала и pH, равновесные концентрации также зависят, например, от температуры, давления и концентрации. Диаграммы Пурбе обычно даются при комнатной температуре, атмосферном давлении и молярных концентрациях 10, и изменение любого из этих параметров приведет к получению другой диаграммы.
Диаграммы названы в честь Марселя Пурбэ (1904–1998), русского бельгийского химика , который их изобрел.
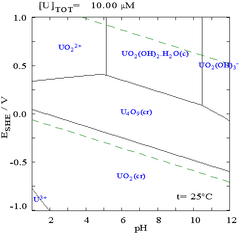 Диаграмма Пурбе для урана в не образующей комплексы водной среда (например, хлорная кислота / гидроксид натрия)
Диаграмма Пурбе для урана в не образующей комплексы водной среда (например, хлорная кислота / гидроксид натрия)  Диаграмма Пурбе для урана в растворе карбоната. Пунктирные зеленые линии показывают пределы устойчивости воды в системе.
Диаграмма Пурбе для урана в растворе карбоната. Пунктирные зеленые линии показывают пределы устойчивости воды в системе. Диаграммы Пурбе также известны как диаграммы E H -pH из-за обозначения двух осей. Вертикальная ось обозначена E H для потенциала напряжения по отношению к стандартному водородному электроду (SHE), рассчитанному по уравнению Нернста. «H» означает водород, хотя могут использоваться и другие стандарты, и они предназначены только для комнатной температуры.
![{\displaystyle E_{\text{H}}=E^{0}-{\frac {V_{T}\lambda }{n}}\log {\frac {[C]^{c}[D]^{d}}{[A]^{a}[B]^{b}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee5e4550e539eb3a29ea4281eb96eb9bc5115bfe)
где 


Линии на диаграмме Пурбе показывают условия равновесия, то есть, когда активности равны, для видов по обе стороны от этой линии. По обе стороны от линии, вместо этого будет сказано, что преобладает одна форма вида.
Чтобы нарисовать положение линий с помощью уравнения Нернста, активность химического вещества в равновесии должна быть определено. Обычно активность какого-либо вещества приблизительно равна концентрации (для растворимых веществ) или парциальному давлению (для газов). Для всех видов, присутствующих в системе, следует использовать одни и те же значения.
Для растворимых веществ линии часто проводят для концентраций 1 М или 10 М. Иногда дополнительные линии проводят для других концентраций.
Если диаграмма включает в себя равновесие между растворенными частицами и газом, давление обычно устанавливается на P = 1 атм = 101325 Па, минимальное давление, необходимое для выделения газа из водного раствора при стандартных условиях.
Хотя такие диаграммы можно нарисовать для любой химической системы, важно отметить, что добавление агента, связывающего металл (лиганд ), часто приводит к изменению диаграммы. Например, карбонат оказывает большое влияние на диаграмму для урана. (См. Диаграммы справа). Присутствие следовых количеств определенных частиц, таких как ионы хлора, также может сильно повлиять на стабильность определенных частиц, разрушая пассивирующие слои.
Кроме того, изменения температуры и концентрации сольватированных ионов в растворе будут сдвигать линии равновесия в соответствии с уравнением Нернста.
Диаграммы также не принимают во внимание кинетические эффекты, а это означает, что виды, показанные как нестабильные, на практике могут не реагировать в значительной степени.
Упрощенная диаграмма Пурбе указывает области «невосприимчивости», «коррозии» и «пассивности» вместо стабильных видов. Таким образом, они дают представление о стабильности конкретного металла в конкретной среде. Устойчивость означает, что металл не подвергается воздействию, а коррозия указывает на то, что произойдет общее повреждение. Пассивация происходит, когда металл образует устойчивое покрытие из оксида или другой соли на своей поверхности, лучшим примером является относительная стабильность алюминия из-за оксида алюминия слой, образующийся на его поверхности при воздействии воздуха.
Для простого случая термодинамической системы, состоящей из металла (M) и воды, различные уравнения реакции могут быть записаны в виде:

где r 1 и r 2 - любые реагенты, включающие M, водород и кислород. ция должна быть сбалансирована для M, H, O и заряда. Стандартная свободная энергия Гиббса 
Далее наклон Нернста (или тепловое напряжение ) 
Когда электроны не обмениваются (n = 0), равновесие между r 1 и r 2 не зависит от потенциала электрода, и граничная линия будет вертикальной линией с определенным значением pH. Уравнение реакции можно записать так:
, а баланс энергии записывается как 
![{\displaystyle K=[r_{1}]^{a}[r_{2}]^{b}[{\ce {H2\!O}}]^{c}[{\ce {H+}}]^{d}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87adfc0c9e0154a616838c46c049bc55f29b0b78)
![{\displaystyle \Delta G^{\circ }=-RT\ln([r_{1}]^{a}[r_{2}]^{b}[{\ce {H2O}}]^{c}[{\ce {H+}}]^{d})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6379c0a1205f4e534ff2dece3c377c19b1a91f94)
или, в логарифмах по основанию 10,
![{\displaystyle \Delta G^{\circ }=-(RT\lambda)\,(\log([r_{1}]^{a}[r_{2}]^{b}[{\ce {H2O}}]^{c})-d\,{\ce {pH}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc62325717e1f27690ddbf1cb9bf2657ebdc3d7c)
, которая может быть решена для конкретного значения pH.
Например, рассмотрим систему железа и воды и линию равновесия между ионом железа ионом Fe и гематитом Fe2O3. Уравнение реакции:

что имеет 
![{\ displaystyle {\ ce {pH}} = {\ frac {1} {6}} \ left ({\ frac {\ Delta G ^ {\ circ}} {RT \ lambda}} + \ log \ left ({\ frac {{\ ce {[Fe2O3]} }} {{\ ce {[Fe ^ {3 +}] ^ 2 [H2O] ^ 3}}}} \ right) \ right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed92083e91c693c8205cf35ca48cec5a8f4eb96e)
В STP, для [ Fe] = 10, [Fe 2O3] = [H 2 O] = 1, это дает pH = 1,76.
Когда H и Ионы ОН не участвуют, граница горизонтальная, не зависит от pH. Уравнение реакции записывается:

Энергетический баланс
![{\displaystyle \Delta G=\Delta G^{\circ }-(RT)\ln[r_{1}]^{a}[r_{2}]^{b}[{\ce {H2O}}]^{c}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/49573779d6c31dd6dcae88b60beb35e8384fc098)
Использование определения электродного потенциала ∆G = -FE это можно переписать как уравнение Нернста:
![{\displaystyle E_{h}={E^{\circ }}+{\frac {V_{T}}{n}}\ln([r_{1}]^{a}[r_{2}]^{b}[{\ce {H2O}}]^{c})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fdc8eecdeb1b7458fc95d793cb9e6277f514298)
или, используя десятичный логарифм:
![{\displaystyle E_{h}={E^{\circ }}+{\frac {V_{T}\lambda }{n}}\log([r_{1}]^{a}[r_{2}]^{b}[{\ce {H2O}}]^{c})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dca188b0b051f5e3d0006b46d6e4ef0d93c66dba)
Для примера железа и воды рассмотрим границу между Fe и Fe. Уравнение реакции:
и, поскольку участвуют электроны, он имеет Eo = 0,771 В, а поскольку ионы H не участвуют, он не зависит от pH. В зависимости от температуры
![{\displaystyle E_{h}={E^{\circ }}+V_{T}\lambda \log \left({\frac {{\ce {[Fe^{2+}]}}}{{\ce {[Fe^{3+}]}}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8d5c40cc273dbc059e29da9efe26d66944aa5c7)
Для обоих ионных частиц при 

В этом случае задействованы как электроны, так и ионы H, и электродный потенциал ntial - это функция pH. Уравнение реакции можно записать так:

Используя выражения для свободной энергии в терминах потенциалов, баланс энергии задается уравнением Нернста:
![{\displaystyle E_{h}={E^{\circ }}+{\frac {V_{T}\lambda }{n}}(\log([r_{1}]^{a}[r_{2}]^{b}[{\ce {H2O}}]^{c})-d\,{\ce {pH}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4ede4b68bc1cb439390de991bba0b50c2b4779e)
Для железа и воды Например, рассмотрим границу между ионом двухвалентного железа Fe и гематитом Fe 2O3. Уравнение реакции выглядит следующим образом:

с 
![{\displaystyle E_{h}={E^{\circ }}-{\frac {V_{T}\lambda }{2}}\left(\log \left({\frac {{\ce {[Fe^{+2}]^2[H2O]^3}}}{{\ce {[Fe2O3]}}}}\right)+6{\ce {pH}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18a9ef1c99cc5b13ceaf698f773290a079c3988f)
Для [Fe 2O3] = [H 2 O] = 1 и [Fe] = 10 это дает E h = 1,0826 - 0,1775 pH.
 Диаграмма Пурбе для воды, включая области равновесия для воды, кислорода и водорода при STP. Вертикальная шкала - это электродный потенциал водорода или невзаимодействующего электрода относительно электрода SHE, горизонтальная шкала - это pH электролита (в противном случае не взаимодействующий). При условии отсутствия перенапряжения, выше верхней линии равновесным условием является газообразный кислород, и кислород будет пузыриться с электрода, пока не будет достигнуто равновесие. Аналогичным образом, ниже нижней линии, равновесным условием является газообразный водород, и водород будет пузыриться с электрода до тех пор, пока не будет достигнуто равновесие.
Диаграмма Пурбе для воды, включая области равновесия для воды, кислорода и водорода при STP. Вертикальная шкала - это электродный потенциал водорода или невзаимодействующего электрода относительно электрода SHE, горизонтальная шкала - это pH электролита (в противном случае не взаимодействующий). При условии отсутствия перенапряжения, выше верхней линии равновесным условием является газообразный кислород, и кислород будет пузыриться с электрода, пока не будет достигнуто равновесие. Аналогичным образом, ниже нижней линии, равновесным условием является газообразный водород, и водород будет пузыриться с электрода до тех пор, пока не будет достигнуто равновесие. Во многих случаях возможные условия в системе ограничены областью устойчивости воды. На диаграмме Пурбе для урана пределы устойчивости воды отмечены двумя пунктирными зелеными линиями, а область устойчивости воды находится между этими линиями.
В условиях сильного восстановления (низкий E H / pE) вода будет восстанавливаться до водорода согласно

или

Использование Уравнение Нернста, устанавливая E = 0 В и летучесть газообразного водорода (соответствующую активности) равным 1, уравнение для нижней линии стабильности воды на диаграмме Пурбе будет иметь следующий вид:

при стандартной температуре и давлении. Ниже этой линии вода будет восстанавливаться до водорода, и обычно невозможно перейти за эту линию, пока есть вода, которую нужно восстановить.
Соответственно, в условиях сильного окисления (высокий E H / pE) вода будет окисляться до газообразного кислорода согласно

Использование уравнения Нернста как указано выше, но с E = -ΔG H2O / 2F = 1,229 В, дает верхний предел устойчивости воды при

при стандартной температуре и давлении. Выше этой линии вода будет окисляться с образованием газообразного кислорода, и, как правило, невозможно выйти за пределы этой линии, пока есть вода, которая может быть окислена.
Диаграммы Пурбе имеют несколько применений, например, в исследованиях коррозии, геонауки и исследования окружающей среды. Использование Pourba Правильная диаграмма ix поможет пролить свет не только на природу частиц, присутствующих в растворе (или образце), но также может помочь понять механизм реакции.
Диаграммы Пурбе широко используются для описания химического поведения химических веществ в гидросфере. В этих случаях восстанавливающий потенциал pE используется вместо E H. pE является безразмерным числом и может быть легко связано с E H уравнением

Значения pE в химии окружающей среды колеблются от -12 до +25, так как при низком или высоком потенциале вода будет соответственно восстановлен или окислен. В экологических приложениях концентрация растворенных веществ обычно устанавливается в диапазоне от 10 M до 10 M для создания линий равновесия.
| На Викискладе есть материалы, связанные с диаграммами Пурбэ. |