 Батарея ртутная "РЦ-53М" (РЦ-53М), российская, 1989 г.в.
Батарея ртутная "РЦ-53М" (РЦ-53М), российская, 1989 г.в. Ртутные батареи (также называемый оксид ртути батареей, ртутный, клетка кнопки, или Ruben-Mallory) не является перезаряжаемой электрохимической батареей, A первичной клетки. В ртутных батареях используется реакция между оксидом ртути и цинковыми электродами в щелочном электролите. Напряжение во время разряда остается практически постоянным - 1,35 В, а емкость намного больше, чем у угольно- цинковой батареи аналогичного размера. Ртутные батареи использовались в форме кнопочных элементов для часов, слуховых аппаратов, фотоаппаратов и калькуляторов, а также в более крупных формах для других приложений.
На какое-то время во время и после Второй мировой войны батареи, изготовленные из ртути, стали популярным источником питания для портативных электронных устройств. Из-за содержания токсичной ртути и экологических опасений по поводу ее утилизации продажа ртутных батарей в настоящее время запрещена во многих странах. И ANSI, и IEC отменили свои стандарты для ртутных батарей.
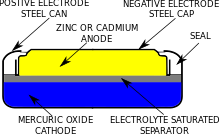 Поперечный разрез ртутной батареи кнопочного типа.
Поперечный разрез ртутной батареи кнопочного типа. Система батарей из оксида ртути и цинка была известна с 19 века, но не получила широкого распространения до 1942 года, когда Самуэль Рубен разработал сбалансированный ртутный элемент, который был полезен для военных приложений, таких как металлоискатели, боеприпасы и рации. Аккумуляторная система имеет преимущества длительного срока хранения (до 10 лет) и стабильного выходного напряжения. После Второй мировой войны аккумуляторная система широко применялась в небольших электронных устройствах, таких как кардиостимуляторы и слуховые аппараты. Аккумуляторы оксида ртути были сделаны в диапазоне размеров от миниатюрных ячеек кнопок, используемых для слуховых аппаратов и электрические наручные часов, цилиндрические типов, используемых для портативного электронного устройства, прямоугольные батареи, используемых для транзисторных радиоприемников, а также крупные многоклеточных пакеты, используемые для промышленных применений, таких как радио дистанционного управление системами мостовых кранов. В Соединенных Штатах ртутные батареи производились такими компаниями, как PR Mallory and Co Inc (ныне Duracell ), Union Carbide Corporation (чье бывшее аккумуляторное подразделение теперь называется Energizer Holdings ), RCA Corporation и Burgess Battery Company.
В ртутных батареях в качестве катода используется либо чистый оксид ртути (II) (HgO), который также называется оксидом ртути, либо смесь HgO с диоксидом марганца (MnO 2). Оксид ртути не является проводником, поэтому с ним смешано некоторое количество графита ; графит также помогает предотвратить скопление ртути в крупные капли. Полуреакция на катоде:
со стандартным потенциалом +0,0977 В.
Анод выполнен из цинка (Zn) и отделен от катода со слоем бумаги или другого пористого материала, пропитанные электролитом; это известно как соляной мост. На аноде происходят две полуреакции. Первый состоит из стадии электрохимической реакции :
с последующей стадией химической реакции : на аноде происходит окисление.
давая полную анодную полуреакцию:
Общая реакция на аккумулятор:
Другими словами, во время разряда цинк окисляется (теряет электроны), превращаясь в оксид цинка (ZnO), в то время как оксид ртути восстанавливается (приобретает электроны) с образованием элементарной ртути. В элемент помещается немного дополнительного количества оксида ртути, чтобы предотвратить выделение газообразного водорода в конце срока службы.
Гидроксид натрия или гидроксид калия используются в качестве электролита. Ячейки с гидроксидом натрия имеют почти постоянное напряжение при малых токах разряда, что делает их идеальными для слуховых аппаратов, калькуляторов и электронных часов. Ячейки с гидроксидом калия, в свою очередь, обеспечивали постоянное напряжение при более высоких токах, что делало их пригодными для приложений, требующих скачков тока, например для фотоаппаратов со вспышкой и часов с подсветкой. Ячейки с гидроксидом калия также лучше работают при более низких температурах. Ртутные элементы имеют очень длительный срок хранения - до 10 лет.
Другая форма ртутной батареи использует оксид ртути и кадмий. У них гораздо более низкое напряжение на клеммах, около 0,9 вольт, и поэтому они имеют более низкую плотность энергии, но имеют расширенный температурный диапазон, в специальных конструкциях до 180 C. Поскольку кадмий имеет низкую растворимость в щелочном электролите, эти батареи имеют длительный срок хранения. Батарея этого типа на 12 В ранее использовалась для детекторов дыма в жилых помещениях. Он был спроектирован как серия ячеек, в которой одна ячейка имела уменьшенную емкость, что привело к очень четкой двухступенчатой характеристике разряда по напряжению. По достижении конца срока службы этот меньший элемент сначала разрядится, что приведет к резкому падению напряжения на клеммах аккумулятора на 0,9 В. Это обеспечило очень предсказуемый и повторяемый способ предупреждения пользователей о необходимости замены батареи, в то время как элементы большей емкости поддерживали нормальную работу устройства.
Ртутные батареи, в которых используется катод из оксида ртути (II), имеют очень плоскую кривую разряда, поддерживая постоянное напряжение 1,35 В (разомкнутая цепь) примерно до последних 5% их срока службы, когда их напряжение быстро падает. Напряжение остается в пределах 1% в течение нескольких лет при небольшой нагрузке и в широком диапазоне температур, что делает ртутные батареи полезными в качестве эталона напряжения в электронных приборах и фотографических люксметрах.
Ртутные батареи с катодами, изготовленными из смеси оксида ртути и диоксида марганца, имеют выходное напряжение 1,4 В и более наклонную кривую разряда.
1991 Европейская комиссия директива 91/157, когда он будет принят государствами - членами, запрещен сбыт определенных типов батарей, содержащих более 25 миллиграммов ртути, или, в случае щелочных аккумуляторов, более чем 0,025% по массе ртути. В 1998 году запрет был распространен на элементы, содержащие более 0,005% ртути.
В 1992 году штат Нью-Джерси запретил продажу ртутных батарей. В 1996 году Конгресс США принял Закон об обращении с ртутьсодержащими и перезаряжаемыми батареями, который запрещал дальнейшую продажу ртутьсодержащих батарей, если производители не предоставили оборудование для утилизации, что фактически запретило их продажу.
Запрет на продажу батарей с оксидом ртути вызвал множество проблем для фотографов, оборудование которых часто зависело от выгодных кривых разряда и длительного срока службы. В качестве альтернативы используются воздушно-цинковые батареи с аналогичной кривой разряда, высокой емкостью, но гораздо меньшим сроком службы (несколько месяцев) и низкими характеристиками в сухом климате; щелочные батареи, напряжение которых сильно меняется в течение срока их службы; и батареи из оксида серебра с более высоким напряжением (1,55 В) и очень плоской кривой разряда, что делает их, возможно, лучшей, хотя и дорогой, заменой после перекалибровки измерителя на новое напряжение.
Специальные адаптеры с диодами Шоттки или германиевыми диодами для снижения напряжения позволяют использовать батареи из оксида серебра в оборудовании, предназначенном для ртутных батарей. Поскольку падение напряжения является нелинейной функцией протекания тока, диоды не дают очень точного решения для приложений, в которых протекание тока значительно меняется. Токи, потребляемые старыми люксметрами CdS, обычно находятся в диапазоне от 10 мкА до 200 мкА (например, серия оборудования Minolta SR-T ). Были разработаны различные типы схем активного регулирования напряжения, использующие SMD- транзисторы или интегральные схемы, однако их часто трудно интегрировать в тесное пространство аккумуляторного отсека. Замены должны работать с минимальным падением напряжения на и без того очень низком напряжении, производимом одним элементом батареи, а отсутствие переключателя питания на многих традиционных экспонометрах и камерах приводит к сверхнизкой мощности (ULP) или крайне низкой мощности (XLP).) дизайн необходим. Многие старые устройства также имеют шасси, подключенное к положительной клемме батареи, а не к ее отрицательной клемме - если это невозможно изменить, необходимая конструкция регулятора отрицательного напряжения еще больше сокращает выбор подходящих электронных компонентов.
Раньше цинковые аноды сухих элементов смешивались с ртутью, чтобы предотвратить побочные реакции цинка с электролитом, которые сокращали срок службы батареи. Ртуть не участвовала в химической реакции аккумулятора. Производители перешли на более чистый сорт цинка, поэтому амальгамирование больше не требуется, и ртуть удаляется из сухого элемента.