 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC (2S, 3S) -1,4- Бис (сульфанил) бутан-2,3-диол | |
| Другие названия (2S, 3S) -1,4-Димеркаптобутан-2,3-диол. D-трео-1,4-Димеркаптобутан-2, 3-диол. D-трео-1,4-димеркапто-2,3-бутандиол. 1,4-дитио- D -реитол. реактив Клеланда. редуктакрил | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.020.427 |
| PubChem CID | |
| UNII | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | C4H10O2S2 |
| Молярная масса | 154,253 г / моль |
| Внешний вид | Белое твердое вещество |
| Точка плавления | от 42 до 43 ° C (от 108 до 109 ° F; От 315 до 316 K) |
| Температура кипения | от 125 до 130 ° C (от 257 до 266 ° F; от 398 до 403 K) при 2 мм рт. Ст. |
| Растворимость в воде | Растворимый |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Информационное окно ссылки | |
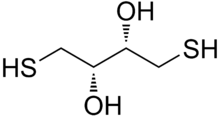
Дитиотреитол (DTT ) - это обычное название низкомолекулярного окислительно-восстановительного реагента, также известного как реагент Клеланда. Формула DTT - C 4H10O2S2, а химическая структура одного из его энантиомеров в его восстановленной форме показана справа; его окисленная форма представляет собой 6-членное кольцо с дисульфидной связью (показано ниже). Реагент обычно используется в его рацемической форме, так как оба энантиомера реакционноспособны. Его название происходит от четырехуглеродного сахара, треозы. DTT содержит эпимерное («сестринское») соединение, дитиоэритрит (DTE).
DTT - это восстановитель ; после окисления он образует стабильное шестичленное кольцо с внутренней дисульфидной связью. Он имеет окислительно-восстановительный потенциал -0,33 В при pH 7. Восстановление типичной дисульфидной связи происходит посредством двух последовательных реакций тиол-дисульфидного обмена, что проиллюстрировано ниже. Восстановление обычно не останавливается на смешанных дисульфидных соединениях, потому что второй тиол DTT имеет высокую склонность закрывать кольцо, образуя окисленный DTT и оставляя восстановленную дисульфидную связь. Снижающая способность DTT ограничена значениями pH выше 7, так как только отрицательно заряженная тиолат форма -S является реакционной (протонированная тиол форма -SH не является); pKa тиоловых групп составляет 9,2 и 10,1.
 Восстановление типичной дисульфидной связи с помощью DTT посредством двух последовательных реакций тиол-дисульфидного обмена.
Восстановление типичной дисульфидной связи с помощью DTT посредством двух последовательных реакций тиол-дисульфидного обмена. DTT используется в качестве восстановителя или " снимающий защиту "агент для тиолированной ДНК. Концевые атомы серы тиолированной ДНК имеют тенденцию к образованию димеров в растворе, особенно в присутствии кислорода. Димеризация значительно снижает эффективность последующих реакций связывания, таких как иммобилизация ДНК на золоте в биосенсорах. Обычно DTT смешивают с раствором ДНК и дают ему прореагировать, а затем удаляют фильтрованием (для твердого катализатора) или хроматографией (для жидкой формы). Процедуру удаления DTT часто называют «обессоливанием». Как правило, DTT используется в качестве защитного агента, который предотвращает окисление тиоловых групп.
DTT часто используется для уменьшения дисульфидных связей в белков и, в более общем смысле, для предотвращают образование внутримолекулярных и межмолекулярных дисульфидных связей между остатками цистеина белков. Однако даже DTT не может восстанавливать скрытые (недоступные для растворителя) дисульфидные связи, поэтому восстановление дисульфидных связей иногда проводят в денатурирующих условиях (например, при высоких температурах или в присутствии сильного денатурирующего агента, такого как 6 M хлорид гуанидиния, 8 M мочевина или 1% додецилсульфат натрия ). DTT часто используется вместе с додецилсульфатом натрия в SDS-PAGE для дальнейшей денатурации белков за счет уменьшения их дисульфидных связей, чтобы обеспечить лучшее разделение белков во время электрофореза. Из-за способности уменьшать дисульфидные связи, DTT может использоваться для денатурирования CD38 на красных кровяных тельцах. И наоборот, воздействие растворителя на различные дисульфидные связи можно оценить по скорости их восстановления в присутствии DTT.
DTT может также использоваться как окислитель. Его главное преимущество состоит в том, что фактически не заселяются никакие виды смешанных дисульфидов, в отличие от других агентов, таких как глутатион. В очень редких случаях может образовываться DTT аддукт, т.е. два атома серы DTT могут образовывать дисульфидные связи с разными атомами серы; в таких случаях DTT не может циклизоваться, поскольку в нем нет таких оставшихся свободных тиолов.
ДТТ нестабилен в окружающих атмосферных условиях, так как окисляется кислородом; DTT следует хранить и обрабатывать в среде инертных газов, чтобы предотвратить окисление. Срок годности дитиотреитола можно продлить при охлаждении до 2–8 ° C. Окисление представляет дополнительные осложнения, поскольку окисленный DTT показывает сильный пик поглощения при 280 нм. Поскольку тиолы менее нуклеофильны, чем их конъюгированные основания, тиолаты, DTT становится менее активным нуклеофилом при понижении pH. (2S) -2-амино-1,4-димеркаптобутан (дитиобутиламин или DTBA) представляет собой новый агент, восстанавливающий дитиол, который в некоторой степени преодолевает это ограничение DTT. Трис (2-карбоксиэтил) фосфин (TCEP ) является альтернативным восстанавливающим агентом, который более стабилен и эффективен при низких значениях pH, но является объемным и медленно восстанавливает цистины в свернутых белках.
DTT. период полувыведения составляет 40 часов при pH 6,5 и 1,4 часа при pH 8,5 и 20 ° C; его период полураспада дополнительно уменьшается при повышении температуры. Присутствие ЭДТА (этилендиаминтетрауксусная кислота) для хелатирования ионов двухвалентных металлов (Fe, Cu и др.) Значительно увеличивает период полураспада DTT в растворе.