| 5-аминолевулинатсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Димер синтазы аминолевулиновой кислоты, Rhodobacter capsulatus Димер синтазы аминолевулиновой кислоты, Rhodobacter capsulatus | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.37 | ||||||||
| Номер CAS | 9037-14-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | представление IntEnz | ||||||||
| BRENDA | запись BRENDA | ||||||||
| ExPASy | представление NiceZyme | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
синтаза аминолевулиновой кислоты (синтаза ALA, ALAS или синтаза дельта-аминолевулиновой кислоты ) представляет собой фермент ( EC 2.3.1.37 ), который катализирует синтез δ-аминолевулиновой кислоты (ALA), первого общего предшественника в биосинтезе всех тетрапирролов, таких как гемы, кобаламины и хлорофиллы. Реакция следующая:
Этот фермент экспрессируется во всех нерастительных эукариотах и протеобактериях α-класса, и реакцию, которую он катализирует, иногда называют путем Shemin для образования ALA. Другие организмы производят АЛК с помощью трех ферментных путей, известных как путь С5. ALA синтезируется путем конденсации глицина и сукцинил-КоА. У людей транскрипция АЛК-синтазы строго контролируется наличием Fe -связывающих элементов, чтобы предотвратить накопление промежуточных продуктов порфирина в отсутствие железа. В организме есть две формы синтазы ALA. Одна форма экспрессируется в клетках-предшественниках красных кровяных телец (ALAS2 ), тогда как другая (ALAS1 ) экспрессируется повсеместно во всем организме. Форма эритроцитов кодируется геном на хромосоме x, тогда как другая форма кодируется геном на хромосоме 3.
Х-связанная сидеробластная анемия вызывается мутациями. в гене ALA-синтазы на хромосоме X, в то время как неизвестно ни одного заболевания, вызванного мутациями в другом гене. Недавно было показано, что усиление функциональных мутаций в гене эритроид-специфической ALA-синтазы вызывает ранее неизвестную форму порфирии, известную как X-сцепленная доминантная протопорфирия.
PLP-зависимые ферменты распространены, потому что они необходимы для преобразования аминокислот в другие ресурсы. ALAS представляет собой гомодимер с субъединицами аналогичного размера, а активные центры, состоящие из боковых цепей аминокислот, таких как аргинин, треонин и лизин, находятся на границе раздела субъединиц. Белок, извлеченный из R. spheroids, содержит 1600 крат и весит около 80 000 дальтон. Ферментативная активность варьируется для разных источников фермента.
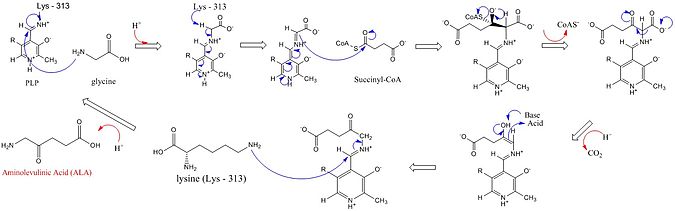
Активные центры ALAS используют три ключевые аминокислотные боковые цепи: Arg-85 и Thr-430 и Lys-313. Хотя эти три аминокислоты были идентифицированы, чтобы позволить этой реакции протекать, они были бы неактивными без добавления кофактора пиридоксаль 5’-фосфата (PLP), роль которого в этом синтезе подробно показана на изображении ниже. Прежде чем реакция может начаться, кофактор PLP связывается с боковой цепью лизина с образованием основания Шиффа, которое способствует атаке глицинового субстрата. Лизин действует как общая основа в этом механизме. В подробном механизме реакции добавляемые атомы гидроксония происходят из различных остатков, которые предлагают водородные связи для облегчения синтеза ALA. ALA-синтаза удаляет карбоксильную группу из глицина и CoA из сукцинил-CoA с помощью его простетической группы пиридоксальфосфат (производное витамина b6), образуя δ-аминолевулиновая кислота (dALA), названная так потому, что группа амино находится на четвертом атоме углерода в молекуле. Этот механизм реакции особенно уникален по сравнению с другими ферментами, которые используют кофактор PLP, потому что глицин первоначально депротонируется высококонсервативным лизином активного центра, что приводит к конденсации с сукцинил-КоА и потере КоА. Протонирование карбонильной группы промежуточного соединения гистидином с активным центром приводит к потере карбоксильной группы. Последний промежуточный продукт, наконец, репротонируется с образованием ALA. Диссоциация ALA от фермента является лимитирующей стадией ферментативной реакции и, как было показано, зависит от медленного конформационного изменения фермента. Функция пиридоксальфосфата состоит в том, чтобы облегчить удаление водорода за счет использования электрофильного пиридинового кольца в качестве поглотителя электронов.
Расположение этого фермента в биологических системах указывает на обратную связь, которую он может получить. АЛК-синтаза была обнаружена в бактериях, дрожжах, печени, клетках крови и костном мозге птиц и млекопитающих. Расположение этого фермента в клетках животных находится в митохондриях. Поскольку фермент, по-видимому, расположен рядом с источником сукцинил-КоА, а конец пути гема указывает на то, что начальная и конечная точки биосинтеза гема служат обратной связью для синтазы ALA. АЛК-синтаза также ингибируется гемином и глюкозой.
 синтезом гема
синтезом гема ALAS1 и ALAS2 катализируют первую стадию процесса синтеза гема. Это первый необратимый шаг, а также ограничение скорости. Это означает, что начало образования гема очень преднамеренное и зависит от множества областей обратной связи. Например, два субстрата, оксалоацетат и глицин, в высокой степени продуцируются и используются в других важных биологических процессах, таких как гликолиз и цикл TCA. Изображение ниже иллюстрирует путь синтеза гема и роль, которую играет ALAS.
 Синтез гема - обратите внимание, что некоторые реакции происходят в цитоплазме, а некоторые - в митохондрии (желтый)
Синтез гема - обратите внимание, что некоторые реакции происходят в цитоплазме, а некоторые - в митохондрии (желтый) Результаты дефицита синтазы аминолевулиновой кислоты из-за отсутствия возможности создавать гем, поскольку его задача - катализировать первый шаг в процессе. Эти недостатки часто являются результатом генетической мутации, которая может привести к различным заболеваниям. Одним из таких заболеваний является сидеробластная анемия, сцепленная с x-хромосомой, которая приводит к появлению красных кровяных телец в костном мозге. Это заболевание конкретно связано с мутациями в генах, кодирующих ALAS2.