 | |
 | |
| Имена | |
|---|---|
| Название IUPAC Иодид титана (IV) | |
| Другие имена Тетраиодид титана | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.028.868 |
| Номер EC |
|
| PubChem CID | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | TiI 4 |
| Молярная масса | 555,485 г / моль |
| Внешний вид | красно-коричневые кристаллы |
| Плотность | 4,3 г / см |
| Точка плавления | 150 ° C (302 ° F, 423 K) |
| Температура кипения | 377 ° C (711 ° F; 650 K) |
| Растворимость в воде | гидролиз |
| Растворимость в других растворителях | растворимый ле в CH 2Cl2. CHCl 3. CS2 |
| Структура | |
| Кристаллическая структура | кубическая (a = 12,21 Å) |
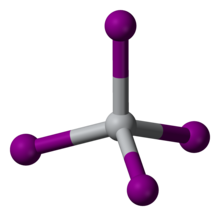
| Координационная геометрия | тетраэдрическая |
| Дипольный момент | 0 D |
| Опасности | |
| Основная опасности | насильственный гидролиз. коррозионный |
| R-фразы (устаревшие) | 34-37 |
| S-фразы (устаревшие) | 26-36 / 37 / 39-45 |
| Родственные соединения | |
| Другие анионы | Бромид титана (IV). Хлорид титана (IV). Фторид титана (IV) |
| Родственные соединения | Титан ( III) йодид |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Тетраиодид титана представляет собой неорганическое соединение с формулой TiI 4. Это летучее твердое вещество черного цвета, о котором впервые сообщил Рудольф Вебер в 1863 году. Это промежуточное соединение в процессе Ван-Аркеля очистки титана.
TiI 4 - редкий молекулярный бинарный металл иодид, состоящий из изолированных молекул тетраэдрических центров Ti (IV). Расстояния Ti-I составляют 261 пм. Отражая его молекулярный характер, TiI 4 можно перегонять без разложения при одной атмосфере; это свойство лежит в основе его использования в процессе Ван Аркеля. Разница в температуре плавления TiCl 4 (т.пл. -24 ° C) и TiI 4 (т.пл.150 ° C) сопоставима с разницей между температурами плавления CCl. 4 (т.пл. -23 ° C) и CI4 (т.пл. 168 ° C), что отражает более сильную межмолекулярную ван-дер-ваальсовую связь в иодидах.
Существуют два полиморфа TiI 4, один из которых хорошо растворим в органических растворителях. В менее растворимой кубической форме расстояния Ti-I составляют 261 pm.
Три метода хорошо известны: 1) Из элементов, обычно с использованием трубчатой печи при 425 ° C:
Эту реакцию можно обратить, чтобы получить пленки металлического Ti высокой чистоты.
2) Реакция обмена из тетрахлорида титана и HI.
3) Оксид-йодидный обмен от иодида алюминия.
Подобные TiCl 4 и TiBr 4, TiI 4 образует аддукты с основаниями Льюиса, и он также может быть восстановлен. Когда восстановление проводят в присутствии металлического Ti, получают полимерные производные Ti (III) и Ti (II), такие как CsTi 2I7и цепной CsTiI 3, соответственно.
TiI 4 проявляет обширную реакционную способность по отношению к алкенам и алкинам, приводя к образованию йодорганических производных. Он также влияет на связывания пинакола и другие реакции образования связи CC.