Доклиническая визуализация - это визуализация живых животных для исследовательских целей, например для разработки лекарств. Методы визуализации уже давно имеют решающее значение для исследователя при наблюдении изменений на уровне органов, тканей, клеток или молекул у животных, реагирующих на физиологические изменения или изменения окружающей среды. Неинвазивные методы визуализации in vivo стали особенно важными для длительного изучения моделей на животных. Вообще говоря, эти системы визуализации можно разделить в первую очередь на морфологические / анатомические и в первую очередь на молекулярные методы визуализации. Для анатомической визуализации обычно используются такие методы, как высокочастотный микро-ультразвук, магнитно-резонансная томография (МРТ) и компьютерная томография (КТ), в то время как оптическая визуализация (флуоресценция и биолюминесценция ), позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (SPECT) обычно используются для молекулярной визуализации.
В наши дни многие производители предлагают мультимодальные системы, сочетающие в себе преимущества анатомических методов, таких как КТ и МРТ, с функциональной визуализацией ПЭТ и ОФЭКТ. Как и на клиническом рынке, распространенными комбинациями являются ОФЭКТ / КТ, ПЭТ / КТ и ПЭТ / МРТ.
Принцип: Высокочастотный микро-ультразвук работает через генерация безвредных звуковых волн от преобразователей в живые системы. Когда звуковые волны распространяются через ткань, они отражаются и улавливаются датчиком, а затем могут быть преобразованы в 2D- и 3D-изображения. Микро-ультразвук специально разработан для исследований мелких животных с частотами от 15 МГц до 80 МГц.
Достоинства: Микро-ультразвук - единственный способ визуализации в реальном времени как таковой, позволяющий собирать данные с точностью до 1000 кадров в секунду. Это означает, что он не только более чем способен визуализировать кровоток in vivo, но и может даже использоваться для изучения высокоскоростных событий, таких как кровоток и сердечная функция у мышей. Микро-ультразвуковые системы портативны, не требуют специального оборудования и чрезвычайно рентабельны по сравнению с другими системами. Это также не сопряжено с риском искажения результатов из-за побочных эффектов радиации. В настоящее время возможно получение изображений размером до 30 мкм, что позволяет визуализировать крошечные сосуды при раке ангиогенезе. Для изображения капилляров это разрешение может быть увеличено до 3-5 мкм с помощью введения контрастных веществ для микропузырьков. Кроме того, микропузырьки могут быть конъюгированы с такими маркерами, как рецепторы активированного гликопротеина IIb / IIIa (GPIIb / IIIa) на тромбоцитах и сгустках, интегрин α vβ3, а также рецепторы фактора роста эндотелия сосудов (VEGFR), чтобы обеспечить молекулярную визуализацию. Таким образом, он может использоваться в широком спектре приложений, которые могут быть достигнуты только с помощью двойных методов визуализации, таких как микро-МРТ / ПЭТ. Микро-ультразвуковые устройства обладают уникальными свойствами, относящимися к интерфейсу ультразвуковых исследований, где пользователи этих устройств получают доступ к необработанным данным, обычно недоступным в большинстве коммерческих ультразвуковых (микро и немикро) систем.
Слабые стороны: В отличие от микро-МРТ, микро-КТ, микро-ПЭТ и микро-ОФЭКТ, микро-ультразвук имеет ограниченную глубину проникновения. По мере увеличения частоты (как и разрешения) максимальная глубина изображения уменьшается. Обычно с помощью микро-ультразвука можно получить изображение ткани примерно на 3 см ниже кожи, и этого более чем достаточно для мелких животных, таких как мыши. Часто считается, что качество ультразвуковой визуализации связано с опытом и навыками оператора. Однако это быстро меняется, поскольку системы проектируются в удобные для пользователя устройства, дающие хорошо воспроизводимые результаты. Еще один потенциальный недостаток микро-ультразвука состоит в том, что целевые контрастные вещества микропузырьков не могут диффундировать из сосудистой сети даже в опухоли. Однако на самом деле это может быть полезно для таких применений, как перфузия опухоли и визуализация ангиогенеза.
Исследования рака: Достижения в области микро-ультразвука помогли в исследованиях рака множеством способов. Например, исследователи могут легко определить размер опухоли в двух и трех измерениях. Мало того, скорость и направление кровотока также можно наблюдать с помощью ультразвука. Кроме того, микро-ультразвук можно использовать для обнаружения и количественной оценки кардиотоксичности в ответ на противоопухолевую терапию, поскольку это единственный метод визуализации, который обеспечивает мгновенное получение изображения. Поскольку микро-ультразвук работает в режиме реального времени, он также может управлять микроинъекциями лекарств, стволовых клеток и т. Д. Мелким животным без хирургического вмешательства. Контрастные агенты могут быть введены животному для выполнения перфузии опухоли в реальном времени, а также для целенаправленной молекулярной визуализации и количественной оценки биомаркеров. Недавно было даже показано, что микро-ультразвук является эффективным методом доставки генов.
В отличие от обычного микро-ультразвукового устройства с ограниченной чувствительностью кровотока, специально предназначенного для реального time было показано, что сверхбыстрые ультразвуковые сканеры с соответствующей последовательностью и обработкой могут фиксировать очень тонкие гемодинамические изменения в мозге мелких животных в режиме реального времени. Эти данные затем могут быть использованы для вывода нейрональной активности через нейрососудистую связь. Метод функциональной ультразвуковой визуализации (fUS) можно рассматривать как аналог функциональной магнитно-резонансной томографии (fMRI). fUS можно использовать для ангиографии мозга, картирования функциональной активности мозга, функциональной связи мозга от мышей к приматам, включая бодрствующих животных.
Принцип :Фотоакустическая томография (PAT) работает с естественным явлением термопластического расширения тканей при стимуляции внешними электромагнитными волнами, такими как короткий лазер. импульсы. Это вызывает излучение ультразвуковых волн из этих тканей, которые затем могут быть захвачены ультразвуковым преобразователем. Термоупругое расширение и возникающая в результате ультразвуковая волна зависят от длины волны используемого света. PAT обеспечивает полную неинвазивность при визуализации животного. Это особенно важно при работе с моделями опухолей головного мозга, которые, как известно, сложно изучать.
Достоинства: Micro-PAT можно охарактеризовать как метод визуализации, применимый в большом количестве функций. Он сочетает в себе высокую чувствительность оптического изображения с высоким пространственным разрешением ультразвукового изображения. По этой причине он может не только отображать структуру, но и разделять различные типы тканей, изучать гемодинамические ответы и даже отслеживать молекулярные контрастные вещества, конъюгированные с конкретными биологическими молекулами. Кроме того, он неинвазивен и может быть выполнен быстро, что делает его идеальным для продольных исследований одного и того же животного.
Слабые стороны: Поскольку micro-PAT все еще ограничена проникающей силой света и звука, у него нет неограниченной глубины проникновения. Однако достаточно пройти через череп крысы и получить изображение на глубину до нескольких сантиметров, что более чем достаточно для большинства исследований на животных. Еще один недостаток микро-PAT состоит в том, что он полагается на оптическое поглощение ткани для получения обратной связи, и поэтому плохо васкуляризованные ткани, такие как простата, трудно визуализировать. На сегодняшний день на рынке представлены 3 коммерчески доступные системы, а именно VisualSonics, iThera и Endra, последняя из которых является единственной машиной, выполняющей получение реальных трехмерных изображений.
Исследования рака: Изучению рака головного мозга в значительной степени препятствовало отсутствие удобных методов визуализации для изучения животных in vivo. Для этого часто требуется краниотомия в дополнение к часам анестезии, механической вентиляции и т. Д., Что значительно изменяет параметры эксперимента. По этой причине многие исследователи довольствовались тем, что приносили в жертву животных в разные моменты времени и изучали ткань мозга с помощью традиционных гистологических методов. По сравнению с продольным исследованием in vivo для получения значимых результатов требуется гораздо больше животных, и чувствительность всего эксперимента ставится под сомнение. Как указывалось ранее, проблема заключается не в нежелании исследователей использовать методы визуализации in vivo, а в отсутствии подходящих. Например, хотя оптическая визуализация обеспечивает быстрые функциональные данные и анализ окси- и дезокси гемоглобина, она требует трепанации черепа и обеспечивает лишь несколько сотен микрометров глубины проникновения. Кроме того, он сосредоточен на одной области мозга, в то время как исследования явно показали, что функции мозга взаимосвязаны в целом. С другой стороны, микро- фМРТ чрезвычайно дорого обходится и обеспечивает низкое разрешение и время получения изображения при сканировании всего мозга. Он также предоставляет мало информации о сосудистой сети. Было продемонстрировано, что Micro-PAT является значительным улучшением существующих устройств нейровизуализации in vivo. Он быстрый, неинвазивный и обеспечивает вывод большого количества данных. Micro-PAT может отображать мозг с высоким пространственным разрешением, обнаруживать контрастные вещества, нацеленные на молекулы, одновременно определять количественные параметры, такие как SO2 и HbT, и предоставлять дополнительную информацию из функциональных и молекулярных изображений, что было бы чрезвычайно полезно для количественной оценки опухолей и клеточно-ориентированной терапии.
 Микро-МРТ от Magnex Scientific
Микро-МРТ от Magnex Scientific Принцип: Магнитно-резонансная томография (МРТ) использует ядерное магнитное выравнивание различных атомов внутри магнитное поле для создания изображений. Аппараты МРТ состоят из больших магнитов, которые создают магнитные поля вокруг объекта анализа. Эти магнитные поля заставляют парамагнитные атомы, такие как водород, гадолиний и марганец, выстраиваться в магнитном диполе вдоль магнитных полей, создаваемых радиочастотными (RF) катушками внутри аппарата МРТ.. Что машина улавливает от объекта, так это релаксацию атомов, когда они возвращаются к своему нормальному выравниванию, когда РЧ импульс временно прекращается. Используя эти данные, компьютер сгенерирует изображение объекта на основе резонансных характеристик различных типов тканей.
 Безкриогенная доклиническая система МРТ 7T - это показывает серию MRS 7000
Безкриогенная доклиническая система МРТ 7T - это показывает серию MRS 7000 С 2012 года использование безкриогенной магнитной технологии значительно снизило требования к инфраструктуре и зависимость от доступности криогенных хладагентов, которые все труднее получить.
Достоинства: Преимущество микро-МРТ состоит в том, что она имеет хорошее пространственное разрешение, до 100 мкм и даже 25 мкм в очень сильных магнитных полях. Он также имеет отличное контрастное разрешение, чтобы различать нормальную и патологическую ткань. Микро-МРТ можно использовать в самых разных областях, включая анатомическую, функциональную и молекулярную визуализацию. Кроме того, поскольку механизм микро-МРТ основан на магнитном поле, он намного безопаснее по сравнению с методами визуализации на основе излучения, такими как микро-КТ и микро-ПЭТ.
Слабые стороны: Один из самых больших недостатков микро-МРТ - это его стоимость. В зависимости от магнитной силы (которая определяет разрешение) системы, используемые для визуализации животных с плотностью магнитного потока от 1,5 до 14 тесла, варьируются от 1 до 6 миллионов долларов, при этом большинство систем стоит около 2 миллионов долларов. Кроме того, время получения изображения чрезвычайно велико и составляет минуты и даже часы. Это может негативно повлиять на животных, которые находятся под наркозом в течение длительного времени. Кроме того, микро-МРТ обычно делает снимок объекта во времени, и поэтому он не может хорошо изучить кровоток и другие процессы в реальном времени. Даже с учетом последних достижений в области высокопроизводительной функциональной микро-МРТ, для достижения пиковой интенсивности сигнала все еще требуется примерно 10–15 секунд, что затрудняет доступ к важной информации, такой как количественная оценка скорости кровотока.
Исследования рака: Микро-МРТ часто используется для визуализации мозга из-за его способности неинвазивно проникать в череп. Благодаря высокому разрешению микро-МРТ также может обнаруживать ранние опухоли небольшого размера. Связанные с антителами парамагнитные наночастицы также могут быть использованы для увеличения разрешения и визуализации молекулярной экспрессии в системе.
Исследования инсульта и черепно-мозговой травмы: Микро-МРТ часто используется для анатомической визуализации при исследованиях инсульта и черепно-мозговой травмы. Молекулярная визуализация - это новая область исследований.
 Micro-CT system
Micro-CT system  Объемная визуализация реконструированной КТ черепа мыши
Объемная визуализация реконструированной КТ черепа мыши Принцип: Компьютерная томография (КТ) визуализация работает с помощью рентгеновских лучей, которые испускаются сфокусированным источником излучения, который вращается вокруг испытуемого, помещенного в середину КТ-сканера. Рентгеновское излучение ослабляется с разной скоростью в зависимости от плотности ткани, через которую он проходит, а затем улавливается датчиками на противоположном конце КТ-сканера от источника излучения. В отличие от традиционного 2D-рентгеновского излучения, поскольку источник излучения в компьютерном томографе вращается вокруг животного, серия 2D-изображений затем может быть объединена компьютером в 3D-структуры.
Достоинства: Micro-CT может иметь отличное пространственное разрешение, которое может достигать 6 мкм в сочетании с контрастными веществами. Однако доза облучения, необходимая для достижения такого разрешения, смертельна для мелких животных, а пространственное разрешение 50 мкм лучше отражает пределы возможностей микро-КТ. Это также неплохо с точки зрения времени получения изображения, которое для мелких животных может составлять несколько минут. Кроме того, микро-КТ отлично подходит для визуализации костей.
Слабые стороны: Одним из основных недостатков микро-КТ является дозировка излучения, применяемая для подопытных животных. Хотя это обычно не смертельно, радиация достаточно высока, чтобы повлиять на иммунную систему и другие биологические пути, что в конечном итоге может изменить результаты экспериментов. Кроме того, облучение может влиять на размер опухоли в моделях рака, так как оно имитирует лучевую терапию, и поэтому могут потребоваться дополнительные контрольные группы для учета этой потенциальной смешивающей переменной. Кроме того, контрастное разрешение микро-КТ довольно низкое, и поэтому оно не подходит для различения схожих типов тканей, таких как нормальные и больные ткани.
Исследования рака: Микро-КТ наиболее часто используется в качестве системы анатомической визуализации при исследованиях на животных из-за преимуществ, упомянутых ранее. Также можно вводить контрастные вещества для исследования кровотока. Однако контрастные вещества для микро-КТ, такие как йод, трудно конъюгировать с молекулярными мишенями1, и поэтому он редко используется в методах молекулярной визуализации. Таким образом, микро-КТ часто сочетается с микро-ПЭТ / ОФЭКТ для анатомической и молекулярной визуализации в исследованиях.
Принцип :позитронно-эмиссионная томография ( ПЭТ) изображает живые системы путем регистрации высокоэнергетических γ-лучей, испускаемых изнутри объекта. Источником излучения являются биологические молекулы, излучающие позитроны, такие как 18F-FDG (флудезоксиглюкоза), которые вводятся испытуемому. Когда радиоизотопы распадаются, они испускают позитроны, которые аннигилируют с электронами, которые естественным образом находятся в организме. Это производит 2 γ-кванта на расстоянии ~ 180 ° друг от друга, которые улавливаются датчиками на противоположных концах ПЭТ-машины. Это позволяет локализовать отдельные выбросы в организме, а набор данных реконструируется для получения изображений.
Сильные стороны: Сила микро-ПЭТ в том, что, поскольку источник излучения находится внутри животного, он имеет практически неограниченную глубину изображения. Время сбора данных также достаточно быстрое, обычно около минут. Поскольку разные ткани имеют разную скорость поглощения молекулярных зондов с радиоактивной меткой, микро-ПЭТ также чрезвычайно чувствителен к молекулярным деталям, и поэтому для визуализации необходимы только нанограммы молекулярных зондов.
Слабые стороны: Радиоактивные изотопы, используемые в микро-ПЭТ. имеют очень короткий период полураспада (110 мин для 18F-FDG). Для производства этих изотопов необходимы циклотроны в радиохимических лабораториях в непосредственной близости от машин для микро-ПЭТ. Кроме того, облучение может повлиять на размер опухоли в моделях рака, так как оно имитирует лучевую терапию, и поэтому могут потребоваться дополнительные контрольные группы для учета этой потенциальной мешающей переменной. Micro-PET также страдает низким пространственным разрешением около 1 мм. Для проведения всестороннего исследования, включающего не только молекулярную визуализацию, но и анатомическую визуализацию, необходимо использовать микро-ПЭТ в сочетании с микро-МРТ или микро-КТ, что еще больше снижает доступность для многих исследователей из-за высокой стоимости и специализированных объекты.
Исследования рака: ПЭТ обычно широко используется в клинической онкологии, поэтому результаты исследований на мелких животных легко переводятся. Из-за того, как 18F-FDG метаболизируется тканями, он приводит к интенсивному радиоактивному мечению при большинстве видов рака, таких как опухоли мозга и печени. Почти любое биологическое соединение можно проследить с помощью микро-ПЭТ, если оно может быть конъюгировано с радиоизотопом, что делает его пригодным для изучения новых путей.
 Tc-MDP-сканирование мыши с высоким разрешением SPECT: анимированное изображение вращающихся проекций максимальной интенсивности.
Tc-MDP-сканирование мыши с высоким разрешением SPECT: анимированное изображение вращающихся проекций максимальной интенсивности. Принцип: Подобно ПЭТ, однофотонная эмиссионная компьютерная томография (SPECT) также отображает живые системы с помощью γ-лучей, испускаемых изнутри объекта. В отличие от ПЭТ, радиоизотопы, используемые в ОФЭКТ (такие как технеций-99m ), испускают γ-лучи напрямую, а не в результате аннигиляции позитрона и электрона. Эти лучи затем захватываются γ-камерой, вращающейся вокруг объекта, и затем преобразуются в изображения.
Достоинства: Преимущество этого подхода состоит в том, что ядерные изотопы гораздо более доступны, дешевле и имеютболее длительный период полураспада по сравнению с изотопами микро-ПЭТ. Как и микро-ПЭТ, микро-ОФЭКТ также имеет очень хорошую чувствительность, и требуются только нанограммы молекулярных зондов. Кроме того, за счет использования радиоизотопов разной энергии, конъюгированных с разными молекулярными мишенями, микро-ОФЭКТ имеет преимущество перед микро-ПЭТ в том, что он может отображать несколько молекулярных событий одновременно. В то же время, в отличие от микро-ПЭТ, микро-ОФЭКТ может достичь очень высокого пространственного разрешения, исследуя принцип коллимации точечного отверстия (Бикман и др.). В этом подходе, помещая объект (например, грызуна) близко к апертуре точечного отверстия, можно добиться большого увеличения его на поверхности детектора и эффективно компенсировать собственное разрешение проекции кристалла.
Слабые стороны: Микро-ОФЭКТ все еще имеет значительное излучение, которое может повлиять на физиологические и иммунологические пути у мелких животных. Кроме того, облучение может влиять на размер опухоли в моделях рака, так как оно имитирует лучевую терапию, и поэтому оно может потребоваться дополнительные контрольные группы для этой потенциальной смешивающей группы. Микро-ОФЭКТ также может быть на два порядка менее чувствительным, чем ПЭТ. Кроме того, для мечения соединений изотопами микро-ОФЭКТ требуется хелатирующая молярность, которая может попробовать их биохимические или физические свойства.
Исследования: Микро-ОФЭКТ часто используется в исследованиях рака для молекулярной визуализации раковых лигандов. Его также можно использовать для изображения мозга из-за его проникающей способности. Могут быть новые радиоизотопы, включающие наночастицы, такие как наночастицы оксида железа с меткой 99mTC, они должны быть объединены с системами доставки лекарств в будущем.
Разработаны следующие системы ОФЭКТ для мелких животных в различных группах и коммерчески доступны:
| Артикул | Марка | Описание системы | Радиус вращения (см) | Разрешение (мм) | Чувствительность (имп. / МБк) |
|---|---|---|---|---|---|
| Sajedi et al., 2014, | HiReSPECT | Пиксельные кристаллы CsI (Tl), коллиматор с параллельными отверстиями LEHR, визуализация крыс и мышей | 25 | 1,7 | 36 |
| Magota et al., 2011, | Inveon | кристаллы NaI (Tl), 0,5 мм коллиматоры с одиночным отверстием | 25 | 0,84 | 35,3 |
| фургон der Have et al., 2009, Иващенко и др., 2015, | U-SPECT II | три неподвижных кристалла NaI (Tl), 75 отверстий в 5 кольцах, без мультиплексирования | NA | 0,25 наилучшее | 340 (0,25 мм) 13000 лучших |
| Del Guerra et al., 2007, | X -SPE CT | два взаимодействующих детектора NaI (Tl), различные апертуры | NA | 0,62 наилучшее | 855 |
 На изображении мультимодальной системы 3T доклинической МРТ с прикрепляемым ПЭТ для последовательной визуализации.
На изображении мультимодальной системы 3T доклинической МРТ с прикрепляемым ПЭТ для последовательной визуализации. Принцип: Технология ПЭТ-МРТ для визуализации животных предлагает крупный прорыв в технологии высокопроизводительной функциональной визуализации, в частности в системе МРТ, не без криогенов. Система ПЭТ-МРТ обеспечивает превосходный контраст мягких тканей и возможности молекулярной визуализации для отличной визуализации, количественной оценки и трансляционных исследований. Доклиническая система ПЭТ-МРТ может установить для одновременной мультимодальной визуализации. Использование безкриогенных магнитов также снижает требования к инфраструктуре и снижает зависимость от доступности криогенных хладагентов, которые все труднее получить.
Сильные стороны: Исследователи могут использовать автономную операцию ПЭТ или МРТ или использовать мультимодальную визуализацию. Методы ПЭТ и МРТ могут быть независимо (с использованием системы ПЭТ или МРТ в автономных устройствах), либо последовательно (с помощью прикрепляемого ПЭТ) перед отверстием системы МРТ или одновременно (с ПЭТ вставлен внутрь магнита МРТ). Это позволяет гораздо быстрее получить более точную картину. При одновременном использовании систем ПЭТ и МРТ рабочий процесс в лаборатории может быть увеличен. Система MR-PET от MR Solutions включает в себя новейшую кремниевых фотоумножителей (SiPM), которая значительно уменьшает размер системы и позволяет избежать проблем, связанных с использованием устаревших типов детекторов в магнитном поле МРТ. Рабочие характеристики SiPM аналогичны обычным PMT, но с практическими преимуществами твердотельной технологии.
Слабые стороны: Диагностика визуализации. При последовательной ПЭТ-МРТ оператору необходимо немного времени, чтобы переместить объект между позицией получения ПЭТ и МРТ. В согласовной ПЭТ-МР это отсутствует. Однако в последовательных системах ПЭТ-МР само кольцо ПЭТ можно легко закрепить или снять и перенести из одного помещения в другое использование. Исследователю требуются достаточные знания для интерпретации изображений и данных из двух разных систем, и для этого обучения потребуется.
Исследования: рака Комбинация МРТ и ПЭТ намного эффективнее по времени, чем использование одного метода за раз. Изображения из двух модальностей также могут быть зарегистрированы гораздо более точно, поскольку временная задержка между модальностями ограничена для последовательных систем ПЭТ-МРТ и практически отсутствует для одновременных систем. Это означает, что возможность грубого перемещения объекта между съемками практически отсутствует.
 Доклиническая система визуализации прикрепляемой ОФЭКТ
Доклиническая система визуализации прикрепляемой ОФЭКТ Принцип: Новая ОФЭКТ-МРТ для визуализации мелких животных на технологии множественных отверстий, что обеспечивает высокое разрешение и высокую чувствительность. В сочетании с безкриогеновой МРТ комбинированная технология ОФЭКТ-МР увеличивает рабочий процесс в исследовательских лабораториях, одновременно снижая требования к лабораторной инфраструктуре и сниженная уязвимость к поставкам криогена.
Сильные стороны: Исследовательским центрам больше не нужно выбирать между различными конфигурациями образа системы. Каждое оборудование для ОФЭКТ или МРТ можно использовать как автономное устройство на столе, или же последовательную визуализацию можно выполнить, прикрепив модуль ОФЭКТ к системе МРТ. Животное автоматически переводится из одной модальности другую по той же оси. Вставив модуль ОФЭКТ внутрь магнита МРТ, возможно получение данных ОФЭКТ и МРТ. Рабочий процесс лаборатории может быть увеличен за счет получения нескольких модальностей одного и того же предмета за один сеанс или за счет раздельного использования систем ОФЭКТ и МРТ с одновременной визуализацией разных предметов. ОФЭКТ-МРТ доступен в различных конфигурациях с разным трансаксиальным полем изображения, что позволяет получить от мышей к крысам.
Слабые стороны: Диагностика системы визуализации, недостатки, связанные с тем или иным методом визуализации, больше не применимы. При последовательной ОФЭКТ-МРТтору необходимо немного времени, чтобы переместить объект между позициями получения ОФЭКТ и МРТ. Это исключается при одновременной ОФЭКТ-МРТ. Тем не менее, не менее, для последовательной ОФЭКТ-МРТ, когда модуль ОФЭКТ закреплен, его легко прикреплять или снимать и переносить между комнатами. Исследователь должен обладать достаточными знаниями для интерпретации двух различных систем, и для этого обучения потребуется.
Исследования рака: Комбинация МРТ, которая используется как неинвазивный метод визуализации, и ОФЭКТ дает намного быстрее результаты по сравнению с использованием одной техники за раз. Изображения от двух модальностей также могут быть зарегистрированы гораздо более точно, поскольку временная задержка между модальностями ограничена для последовательных систем SPECT-MR и практически отсутствует для одновременных систем. Это означает, что возможность грубого перемещения объекта между съемками практически отсутствует. Благодаря раздельной, независимой работе систем МРТ и ОФЭКТ рабочий процесс может быть легко увеличен.
Принцип: Оптическая визуализация делится на флуоресценцию и биолюминесценцию.
Достоинства: Оптическое формирование изображения выполняется быстро и легко, и оно относительно недорогое по сравнению со многими из них. другие методы визуализации. Кроме того, он очень чувствителен, как способен проявлять молекулярные события в диапазоне 10–15 M. Кроме того, поскольку для получения изображений биолюминесценции не требуется возбуждение репортера, а, скорее, требуется сама реакция катализа, это свидетельствует о биологическом / молекулярном процессе и почти не имеет фонового шума.
Слабые стороны: Основным недостатком оптических изображений является глубина проникновения, которая в случае видимых красителей составляет всего несколько миллиметров. Флуоресценция в ближнем инфракрасном диапазоне достижения глубины в несколько сантиметров. Эти светодиоды в инфракрасной области имеют лучшую глубину проникновения, флуорохромы 76 были специально разработаны для оптимального возбуждения в области. Оптическая визуализация, флуоресценция имеет разрешение, ограниченное дифракцией света ~ 270 нм, биолюминесценция имеет разрешение ~ 1–10 мм, в зависимости от времени получения, по сравнению с МРТ на 100 мкм и микро-ультразвуком на 30 мкм.
Исследования рака: Из-за малой глубины проникновения оптическая визуализация обычно используется для молекулярных целей, а не для анатомической визуализации. Из-за малой глубины проникновения в видимом диапазоне длин волн он используется для подкожных моделей рака, однако флуоресценция в ближнем инфракрасном диапазоне позволяет создание ортотопических моделей. Часто исследование специфической экспрессии белка при раке и влияние лекарств на эти проявления изучаются in vivo с использованием генно-инженерных светоизлучающих репортерных генов.
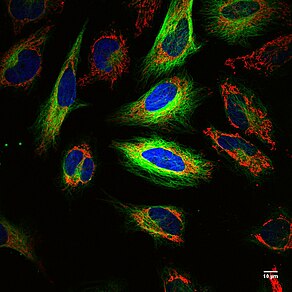 Многоцветная флуоресцентная визуализация живые клетки HeLa с мечеными митохондриями (красный), актином (зеленый) и ядрами (синие). Каждая ячейка имеет размер ~ 10 мкм, и изображения показывают, что оптическое изображение допускает разрешение ≤1 мкм.
Многоцветная флуоресцентная визуализация живые клетки HeLa с мечеными митохондриями (красный), актином (зеленый) и ядрами (синие). Каждая ячейка имеет размер ~ 10 мкм, и изображения показывают, что оптическое изображение допускает разрешение ≤1 мкм. Принцип: химический состав диоксаборолана позволяет метить радиоактивным фторидом (F ) антитела или эритроцитов, что позволяет выполнять позитронно-эмиссионную томографию (ПЭТ) и флуоресцентную визуализацию рака и кровоизлияний соответственно. Генетическая, излучающая позитрон и флуоресцентная репортерная система человеческого происхождения (HD-GPF) использует человеческий белок, PSMA, неиммуногенный, и небольшую молекулу, излучающую позитроны (связанная с бором F ) и флуоресцентный для двойная модальность ПЭТ и флуоресцентной визуализации клеток с модифицированным геномом, например рак или CAR T -клетки у всей мыши. Комбинация этих методов визуализации была предсказана лауреатом Нобелевской премии 2008 года Роджером Циеном, чтобы компенсировать недостатки отдельных методов визуализации.
Сильные стороны: Сочетает в себе сильные стороны ПЭТ и оптическая визуализация, флуоресценция. ПЭТ позволяет получить анатомическое изображение для определения местоположения меченых клеток у целых животных или людей, поскольку радиоактивная метка, F находится внутри животного или человека с почти неограниченной глубиной проникновения. F имеет период полураспада 110 минут и ограничивает радиоактивное воздействие на животное или человека. Оптическая визуализация обеспечивает высокое разрешение с субклеточным разрешением ~ 270 нм или предел дифракции света, что позволяет визуализировать клетки и локализовать клеточное местоположение на клеточной мембране, эндосомах, цитоплазме или ядрах (см. Рисунок многоцветного изображения). HeLa клетки). Этот метод позволяет маркировать небольшие молекулы, антитела, клетки (раковые и эритроциты ), спинномозговую жидкость, кровоизлияния, рак простаты удаление и отредактированные геномом клетки, экспрессирующие генетически кодируемый человеческий белок, PSMA, отредактированные для визуализации и CAR Т-клетки.
Слабые стороны: Комбинация ПЭТ и оптической визуализации позволяет использовать два агента визуализации, которые компенсируют слабость других. F имеет период полураспада 110 минут, а сигнал PET непостоянен. Флуоресцентные небольшие молекулы обеспечивают постоянный сигнал при хранении в темноте, а не фотообесцвечивании. В настоящее время не существует ни одного прибора, который мог бы отображать сигнал PET и изображение флуоресценции с субклеточным разрешением (см. Рисунок многоцветных клеток HeLa). Для получения изображения ПЭТ, флуоресценции всего органа и флуоресценции отдельных клеток с субклеточным разрешением требуется несколько инструментов.