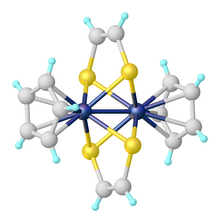
 Структура Mo (S 2 C 2 Ph 2 ) 3.
Структура Mo (S 2 C 2 Ph 2 ) 3. Металлические комплексы дитиолена представляют собой комплексы, содержащие 1,2-дитиоленовые лиганды. 1,2-дитиоленовые лиганды, частный случай 1,2-дихалькогеноленов, представляют собой ненасыщенный бидентатный лиганд, в котором два донорных атома представляют собой серу. Металлические комплексы 1,2-дитиолен часто называют «дитиолены металлов», «металлодитиолены» или «дитиоленовые комплексы». Большинство белков, содержащих молибден и вольфрам, имеют в своих активных центрах дитиоленоподобные фрагменты, в которых присутствует так называемый кофактор молибдоптерина, связанный с Mo или W.
Металлические комплексы дитиолена изучаются с 1960-х годов, когда они были впервые популяризированы Герхардом Н. Шраузером и Фолькером П. Мэйвегом, которые получили бис (стильбен-1,2-дитиолат) никеля (Ni (S 2 C 2 Ph 2 ) 2 ) по реакции сульфида никеля и дифенилацетилена. Описаны структурные, спектроскопические и электрохимические свойства многих родственных комплексов.
Металлические комплексы дитиолена могут быть обнаружены там, где металлический центр координирован одним, двумя или тремя дитиоленовыми лигандами. Трис (дитиоленовые) комплексы были первыми примерами тригонально-призматической геометрии в координационной химии. Одним из примеров является Mo (S 2 C 2 Ph 2 ) 3. Подобные структуры наблюдались и для нескольких других металлов.
 Образец (Et 4 N) 2 Ni ( mnt ) 2, демонстрирующий интенсивный цвет, характерный для многих дитиоленовых комплексов.
Образец (Et 4 N) 2 Ni ( mnt ) 2, демонстрирующий интенсивный цвет, характерный для многих дитиоленовых комплексов. Из-за необычных окислительно-восстановительных и сильных оптических свойств дитиоленов электронная структура дитиоленовых комплексов является предметом интенсивных исследований. 1,2-дитиоленовые лиганды могут существовать в трех степенях окисления : дианионный «ен-1,2-дитиолат», нейтральный «1,2-дитиокетон» и моноанионный радикал, промежуточный между этими двумя. Когда два последние образует комплекс с металлическим центром, то степень окисления от лиганда (и, следовательно, металлического центра) не может быть легко определена. Поэтому такие лиганды называют невиновными. Заместители в основной цепи дитиоленового лиганда, R и R ', ожидаемым образом влияют на свойства образующегося комплекса металла. Длинные цепи придают растворимость в менее полярных растворителях. Акцепторы электронов (например, CN, CO 2 Me) стабилизируют восстановленные и анионные комплексы. Известны производные с одинаковыми заместителями, симметричные дитиолены (R = R ') встречаются чаще, чем несимметричные.
Из-за своей делокализованной электронной структуры 1,2-дитиоленовые комплексы подвергаются обратимой окислительно-восстановительной реакции. При окислении дитиоленовые комплексы имеют более выраженный 1,2-дитиокетонный характер. В восстановленных комплексах лиганд принимает более ен-1,2-дитиолатный характер. Эти описания оцениваются путем изучения различий в расстояниях связи CC и CS. Истинная структура лежит где-то между этими резонансными структурами. Отражая невозможность дать однозначное описание структуры, МакКлеверти ввел термин «дитиолен», чтобы дать общее название лиганда, которое не указывает конкретную степень окисления. Это предложение было общепринятым, и теперь термин «дитиолен» стал общепринятым. Лишь недавно было указано на радикальную природу моноанионных 1,2-дитиоленовых лигандов. Хотя сообщалось о нескольких примерах аутентичных дитиоленовых радикалов, диамагнетизм в нейтральных бис (1,2-дитиоленовых) комплексах ионов двухвалентных переходных металлов следует рассматривать как следствие цепной антиферромагнитной связи между двумя радикальными лигандами.
 Предельные резонансные структуры кольца R 2 C 2 S 2 M
Предельные резонансные структуры кольца R 2 C 2 S 2 MМеталлические комплексы 1,2-дитиолен широко встречаются в природе в виде связанных молибдоптерином Mo и W-содержащих ферментов.
 Активный центр фермента ДМСО-редуктазы содержит два лиганда пираноптериндитиолен.
Активный центр фермента ДМСО-редуктазы содержит два лиганда пираноптериндитиолен. Применения 1,2-дитиоленовых комплексов многочисленны и простираются от сверхпроводимости до линейной и нелинейной оптики и биохимии. Коммерческое применение 1,2-дитиоленовых комплексов ограничено. Несколько дитиоленовых комплексов были коммерциализированы в качестве красителей в лазерных приложениях (модуляция добротности, синхронизация мод). 1,2-дитиоленовые комплексы обсуждались в контексте проводимости, магнетизма и нелинейной оптики. Для промышленной очистки олефинов ( алкенов ) было предложено использовать дитиолен-металлические комплексы, связывающие непредельные углеводороды на серных центрах. Однако позже стали очевидны сложности в таких системах, и утверждалось, что потребуются дополнительные исследования, прежде чем использование дитиоленовых комплексов металлов в очистке алкенов может стать практическим.
Большинство дитиоленовых комплексов получают реакцией солей щелочных металлов 1,2-алкенедитиолатов с галогенидами металлов. Тиолат представляет собой сопряженное основание тиола, поэтому алкенедитиолат, формально говоря, является сопряженным основанием алкенедитиола. Обычными алкенедитиолатами являются 1,3-дитиол-2-тион-4,5- дитиолат и малеонитрилдитиолат (мнт 2- ) :
Некоторые алкенедитиолаты образуются in situ, часто в результате сложных органических реакций:
После создания эти анионы используются как лиганды:
Часто изначально образованный, богатый электронами комплекс подвергается самопроизвольному окислению на воздухе:
 Структура (C 5 H 5 ) 2 Mo 2 (S 2 C 2 H 2 ) 2 с мостиковым дитиоленовым лигандом. Его получали добавлением ацетилена к (C 5 H 5 ) 2 Mo 2 S 4.
Структура (C 5 H 5 ) 2 Mo 2 (S 2 C 2 H 2 ) 2 с мостиковым дитиоленовым лигандом. Его получали добавлением ацетилена к (C 5 H 5 ) 2 Mo 2 S 4. Ранний и все еще эффективный метод синтеза дитиоленов включает реакцию α-гидроксикетонов, ацилоинов, с P 4 S 10 с последующим гидролизом и обработкой смеси солями металлов. Этот метод используется для получения Ni [S 2 C 2 Ar 2 ] 2 (Ar = арил).
Хотя 1,2-дитионы встречаются редко и поэтому не являются полезными предшественниками, иногда используются их валентные изомеры, 1,2- дитиеты. Одним из наиболее распространенных дитиетов является дистиллируемый (CF 3 ) 2 C 2 S 2, получаемый в результате реакции элементарной серы и гексафтор-2-бутина. Этот электрофильный реагент окислительно присоединяется ко многим низковалентным металлам с образованием бис- и трис (дитиоленовых) комплексов.
Соединения типа Ni [S 2 C 2 Ar 2 ] 2 были впервые получены реакциями сульфидов никеля с дифенилацетиленом. Более современные версии этого метода включают реакцию электрофильных ацетиленов, таких как диметилацетилендикарбоксилат, с четко определенными полисульфидокомплексами.
Ранние исследования дитиоленовых лигандов, хотя и не называвшиеся этим именем до 1960-х годов, были сосредоточены на хиноксалин-2,3-дитиолатах и 3,4- толуолдитиолатах, которые образуют ярко окрашенные осадки с несколькими металлическими центрами. Такие виды изначально представляли интерес для аналитической химии. Дитиолены, лишенные бензольных основных цепей, представляют собой важное развитие в этой области, особенно малеонитрил-1,2-дитиолат («mnt»), (NC) 2 C 2 S 2 2– и этилендитиолен, H 2 C 2 S 2 2–.